2020-2021學年山東省威海市高二(上)期末化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分,每小題只有一個選項符合題意。
-
1.化學與生產(chǎn)、生活密切相關。下列說法錯誤的是( )
A. 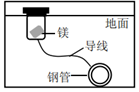
如圖,對鋼管的防護措施為犧牲陽極保護法B.明礬和高鐵酸鉀(K2FeO4)都可凈水,其原理相同 C.侯氏制堿法比索爾維制堿法食鹽的利用率高 D.“保暖貼”在發(fā)熱過程中應用的是原電池的工作原理 組卷:45引用:1難度:0.8 -
2.下列說法正確的是( )
A.玻爾原子結構模型不但成功解釋了氫原子光譜,而且還解釋了其他原子光譜 B.基態(tài)氧原子軌道表示式  違背了泡利不相容原理
違背了泡利不相容原理C.在基態(tài)多電子原子中,p軌道電子能量一定高于s軌道電子能量 D.不同的能層所含的s能級的原子軌道數(shù)是不同的 組卷:76引用:1難度:0.8 -
3.設NA為阿伏加德羅常數(shù)的值。下列說法正確的是( )
A.0.1mol?L-1KHC2O4溶液中含有的C2O42-、HC2O4-和H2C2O4數(shù)目之和為0.1NA B.惰性電極電解飽和食鹽水,當陰極產(chǎn)生NA個OH-,陽極產(chǎn)生11.2L氣體 C.25℃時,1L pH=13的Ba(OH)2溶液中,由水電離的OH-數(shù)目為10-13NA D.NA個N2分子和3NA個H2分子在一定條件下充分反應后,可得到2NA個NH3分子 組卷:14引用:1難度:0.8 -
4.現(xiàn)有6種物質:①N2②NaOH③C2H4④Na2O2⑤H2O2⑥NH4Cl。下列說法正確的是( )
A.既存在單鍵又存在雙鍵的分子只有③ B.既存在非極性鍵又存在極性鍵的極性分子是③⑤ C.既存在σ鍵又存在π鍵的分子只有① D.既存在離子鍵又存在極性共價鍵的是②④⑥ 組卷:149引用:1難度:0.8 -
5.常溫下,下列溶液中各組離子一定能夠大量共存的是( )
A. =0.1mol?L-1的溶液中:SO32-、S2-、Na+、NO3-Kwc(H+)B.使甲基橙變黃的溶液:NH4+、HCO3-、SO42-、K+ C.澄清透明的溶液中:MnO4-、SO42-、Fe2+、K+ D.c(Fe3+)=0.1mol?L-1的溶液中:ClO-、Al3+、CH3COO-、I- 組卷:16引用:1難度:0.6 -
6.下列分子或離子空間結構和中心原子的雜化方式有錯誤的是( )
選項 分子或離子 空間結構 雜化方式 A 苯 平面正六邊形 sp2 B SO42- 正四面體形 sp3 C CO32- 平面三角形 sp2 D SO2 直線形 sp A.A B.B C.C D.D 組卷:219引用:4難度:0.5
三、非選擇題:本題共5小題,共60分。
-
 19.硫和碳是重要的非金屬元素,其單質及化合物在工業(yè)生產(chǎn)中有重要應用。回答下列問題:
19.硫和碳是重要的非金屬元素,其單質及化合物在工業(yè)生產(chǎn)中有重要應用。回答下列問題:
(1)已知:
①H2(g)+12I2(s)═HI(g)△H1=-55kJ?mol-112
②H2(g)+S(s)═H2S(g)△H2=-20kJ?mol-1
③I2(s)+SO2(g)+2H2O(l)═2HI(aq)+H2SO4(aq)△H3=-151kJ?mol-1則反應H2S(g)+H2SO4(aq)═S(s)+SO2(g)+2H2O(l)△H4=。
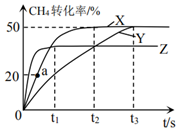
(2)利用CO2與天然氣反應制取H2的原理為:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H>0。在2L密閉容器中通入物質的量均為0.2mol的CH4與CO2,在三種不同條件下反應,測得CH4的轉化率與時間的關系如圖所示。
①下列現(xiàn)象說明反應已經(jīng)達到平衡狀態(tài)的是。(填字母序號)
A.2v(CH4)=v(CO)
B.H2的體積分數(shù)保持不變
C.容器內氣體密度保持不變
D.混合氣體的平均相對分子質量不變
②曲線X對應實驗條件下,從起始至達到平衡時,用H2表示的反應速率v(H2)=;曲線Y對應溫度下該反應的平衡常數(shù)K=。
③由曲線Y到曲線X采取的措施可能是;由曲線X到曲線Z采取的措施可能是。
④反應速率v=v(正)-v(逆)=k(正)xx(CH4)-k(逆)x2(CO)x2(CO2),k(正)、k(逆)分別為正、逆向反應速率常數(shù),x為物質的量分數(shù),計算a處的(H2)=v(正)v(逆)。組卷:19引用:1難度:0.7 -
20.氧族元素及其化合物在生產(chǎn)、生活中發(fā)揮著重要的作用。回答下列問題:
(1)工業(yè)上常用硫化物(FeS等)作沉淀劑除去廢水中的Cu2+等重金屬離子。已知常溫下CuS飽和溶液中,-lgc(Cu2+)和-lgc(S2-)關系如圖1所示,Ksp(CuS)=;圖中a、b、c三點對應的溶液中,一定存在CuS沉淀的是(填序號)。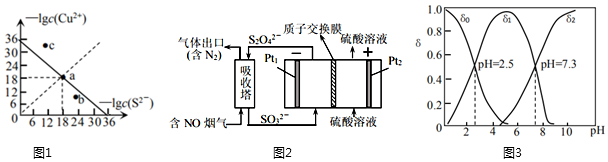
(2)工業(yè)上常用連二亞硫酸鈉(Na2S2O4)消除煙氣中的NO,通過電解可使Na2S2O4再生,裝置如圖2所示。吸收塔內發(fā)生的離子反應方程式為。吸收塔內每吸收11.2L的NO,理論上Pt2電極上會放出L氣體(氣體體積均為標準狀況)。
(3)硒是人體必需的微量元素。工業(yè)上將含硒工業(yè)廢料處理得到亞硒酸(H2SeO3)和硒酸(H2SeO4),進而制備單質硒。亞硒酸(H2SeO3)在溶液中存在多種微粒形態(tài),25℃時各微粒的分布系數(shù)δ與溶液pH的關系如圖3所示。(分布系數(shù)即組分的平衡濃度占總濃度的分數(shù))
①將KOH滴入H2SeO3溶液中,當pH達到2.0時,發(fā)生反應的離子方程式是。
②25℃時,KHSeO3溶液的pH<7,通過計算和必要的文字加以解釋:。
③已知硒酸的電離方程式為:H2SeO4═H++HSeO4-,HSeO4-?H++SeO42-。25℃時,下列關于0.1mol?L-1NaHSeO4溶液的說法錯誤的是。
A.c(Na+)>c(HSeO4-)>c(H+)>c(SeO42-)>c(OH-)
B.c(H+)=c(OH-)+c(SeO42-)+c(H2SeO4)
C.c(HSeO4-)+c(SeO42-)+c(H2SeO4)=0.1mol?L-1
D.c(Na+)+c(H+)=c(HSeO4-)+2c(SeO42-)+c(OH-)組卷:94引用:1難度:0.5


