2021-2022學年廣東省佛山市羅定邦中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(每題2分)
-
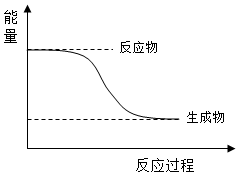 1.下列反應中符合圖示能量變化的是( )
1.下列反應中符合圖示能量變化的是( )A.鋁熱反應 B.Ba(OH)2?8H2O與NH4Cl反應 C.電解Al2O3得到Al和O2 D.灼熱的炭與CO2反應 組卷:11引用:1難度:0.8 -
 2.依據圖示關系,下列說法不正確的是( )
2.依據圖示關系,下列說法不正確的是( )A.石墨燃燒是放熱反應 B.1molC(石墨)和1molCO分別在足量O2中燃燒,全部轉化為CO2,前者放熱多 C.C(石墨)+CO2(g)═2CO(g)ΔH=ΔH1-ΔH2 D.化學反應的ΔH,只與反應體系的始態和終態有關,與反應途徑無關 組卷:758引用:19難度:0.8 -
3.下列關于化學反應與能量的說法正確的是( )
A.已知正丁烷的燃燒熱為2878kJ?mol-1,則表示正丁烷燃燒熱的熱化學方程式為:2CH3 CH2CH2CH3(g)+13O2 (g)═8CO2 (g)+10H2O(l)△H=-2878 kJ?mol-1 B.已知在一定條件下,2 mol SO2與1molO2充分反應后,釋放出98kJ的熱量,則其熱化學方程式為:2SO2(g)+O2(g)?2SO3(g)△H=-98kJ?mol-1 C.已知稀鹽酸與稀NaOH溶液反應的中和熱為57.3kJ?mol-1,則表示稀硫酸與稀NaOH溶液反應的熱化學方程式為: H2SO4(aq)+NaOH(aq)═12Na2SO4(aq)+H2O(l)△H=-57.3kJ?mol-112D.已知CuSO4(s)+5H2O(l)═CuSO4?5H2O(s),該反應為熵增加的反應 組卷:78引用:4難度:0.7 -
4.下列關于有效碰撞理論的說法一定正確的是( )
A.增大反應物濃度,活化分子百分數增大,反應速率加快 B.催化劑在化學反應過程中參與了反應,活化分子數增大,反應速率加快 C.升高溫度,所有反應的活化能增大,反應速率加快 D.增大壓強,所有反應的有效碰撞概率增大,反應速率加快 組卷:24引用:4難度:0.6 -
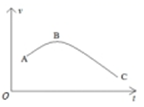 5.將已除去氧化膜的鎂條投入到盛有稀鹽酸的敞口容器中,產生H2的速率v與時間t的關系如圖所示,其中影響AB段速率的主要因素是( )
5.將已除去氧化膜的鎂條投入到盛有稀鹽酸的敞口容器中,產生H2的速率v與時間t的關系如圖所示,其中影響AB段速率的主要因素是( )A.H+的濃度 B.Cl-的濃度 C.溶液的溫度 D.體系的壓強 組卷:277引用:6難度:0.7 -
6.下列事實不能用勒夏特列原理解釋的是( )
A.用排飽和食鹽水來除Cl2中HCl B.開啟啤酒瓶后,瓶中馬上泛起大量泡沫 C.增大壓強,有利于SO2與O2反應生成SO3 D.向雙氧水中加入少量二氧化錳有利于氧氣的生成 組卷:5引用:1難度:0.5
二、非選擇題(共56分)
-
19.鉛的冶煉有很多種方法。
(1)瓦紐科夫法熔煉鉛,其相關反應的熱化學方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H1=akJ?mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H2=bkJ?mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H3=ckJ?mol-1
反應PbS(s)+2O2(g)═PbSO4(S)△H=kJ?mol-1(用含a、b、c的代數式表示)。
(2)還原法煉鉛,包含反應PbO(s)+CO(g)?Pb(s)+CO2(g)△H,該反應的平衡常數的對數值與溫度的關系如表:
a.該反應的△H溫度/℃ 300 727 1227 lgK 6.17 2.87 1.24 0(選填“>”、“<”或“=”)。
b.當lgK=1,在恒容密閉容器中放入PbO并通入CO,達平衡時,混合氣體中CO的體積分數為(保留兩位有 效數字);
(3)若在T、V不變的條件下向容器中充入一定量的N2,平衡(填“正向”、“逆向”或“不”)移動;若向容器中充入一定量的CO氣體,平衡向(填“正向”、“逆向”或“不”)移動,再次達到平衡時,CO的轉化率(填“增大”、“減小”或“不變”)。
(4)若在T、P不變的條件下向容器中充入一定量的N2,化學反應速率的關系為v正v逆。(填“>”、“<”或“=”)組卷:4引用:1難度:0.7 -
20.固氮一直是科學家致力研究的重要課題,有關熱力學數據如下:
回答下列問題:反應 大氣固氮N2(g)+O2(g)═2NO(g) 工業固氮N2(g)+3H2(g)?2NH3(g) 溫度/℃ 25 2000 25 350 400 450 K 3.84×10-31 0.1 5×108 1.847 0.507 0.152 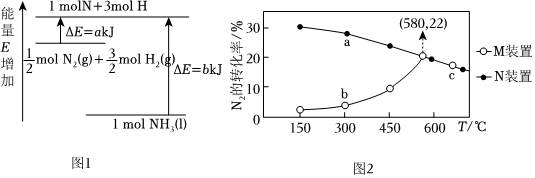
(1)常溫下,大氣固氮的傾向工業固氮(填“大于”或“小于”)。
(2)N2與H2比反應的能量變化如圖1所示(假設該反應進行到底)。
則N2(g)+3H2(g)?2NH3(I)ΔH=kJ?mol-1。
(3)T℃向2L恒容密閉容器中通入3.6mol N2和2molH2模擬工業固氮。體系中n(NH3)隨時間的變化如下:
①前3min內t/min 0 1 2 3 4 5 6 7 n(NH3)/mol 0 0.23 0.45 0.66 0.76 0.80 0.80 0.80 (NH3)=v。
②下列情況能說明該反應達到平衡狀態的是。
A.混合氣體的平均摩爾質量不變
B.混合氣體的密度不變
C.3v正(H2)=2v逆(NH3)
D.混合氣體的壓強不再改變
③該反應的平衡常數為(計算結果保留兩位小數)。
(4)在M、N裝置中,控制相同投料比、相同反應時間,探究溫度和催化劑對工業固氮的影響,數據如圖2,
2低于580℃時,(填“M”或“N”)裝置的催化劑催化效果更好。
②圖中所示三個點中,反應一定達到平衡狀態的是(選填“a”“b”“c”)點。
③由圖可知,為了提高氮氣的轉化率,可以采取的措施是。組卷:18引用:2難度:0.5


