新人教版九年級下冊《第10章 酸和堿》2021年單元測試卷(34)
發布:2024/11/2 20:30:6
一、選擇題(14分)
-
1.下列有關物質混合后的現象描述中,正確的是( )
A.CO通過灼熱的氧化鐵粉末,粉末由紅色變為黑色 B.把生石灰加入到飽和的熟石灰溶液中,固體完全溶解 C.銅絲浸入硫酸鋅溶液中,溶液由無色變為藍色,銅絲表面有一層銀白色物質析出 D.將過量的NaOH溶液逐漸滴入混有石蕊的稀鹽酸中,溶液顏色由紅色逐漸變為無色 組卷:60引用:4難度:0.6 -
2.下列實驗能達到實驗目的的是( )
A. 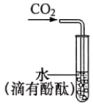
驗證CO2水溶液呈酸性B. 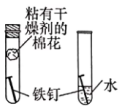
驗證鐵的銹蝕與氧氣有關C. 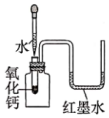
驗證氧化鈣遇水反應放熱D. 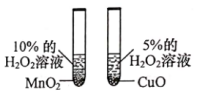
比較MnO2和CuO對H2O2分解的影響組卷:55引用:3難度:0.5 -
3.下列圖象分別與選項中的操作相對應,其中合理的是( )
A. 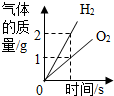
通電分解水B. 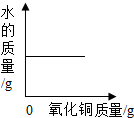
向一定量稀硫酸中加氧化銅C. 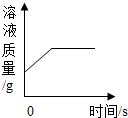
向飽和硝酸鉀溶液中加硝酸鉀D. 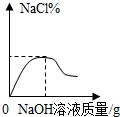
向一定量鹽酸中滴加氫氧化鈉溶液組卷:125引用:2難度:0.8 -
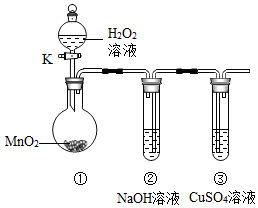 4.如圖所示的實驗中,打開分液漏斗活塞K,滴入少量過氧化氫溶液,對應裝置中現象的描述正確的是( )
4.如圖所示的實驗中,打開分液漏斗活塞K,滴入少量過氧化氫溶液,對應裝置中現象的描述正確的是( )A.裝置①中有氣泡冒出,黑色固體消失 B.裝置②中有氣泡冒出,液面逐漸下降 C.裝置②中液面逐漸上升,產生白色沉淀 D.裝置③中液面逐漸上升,產生藍色沉淀 組卷:46引用:2難度:0.7 -
5.在化學實驗和日常生活中都應強化安全意識。下列做法符合安全要求的是( )
A.使用完酒精燈后,用嘴吹滅 B.家中燃氣泄漏,立即打開排風扇通風 C.點燃氫氣之前,要先檢驗氫氣純度 D.若不慎將氫氧化鈉溶液沾到皮膚上,要立即用稀鹽酸沖洗 組卷:14引用:2難度:0.6 -
6.下列實驗方法錯誤的是( )
A.用無色酚酞鑒別稀硫酸和氫氧化鈉溶液 B.用紫色石蕊溶液鑒別二氧化碳和一氧化碳 C.用稀鹽酸除去鐵粉中混有少量的銅粉 D.用濃硫酸除去氧氣中混有的少量水蒸氣 組卷:16引用:2難度:0.6 -
7.下列實驗中,顏色變化不符合實驗事實的是( )
A.鐵釘放入硫酸銅溶液中,溶液由藍色變為淺綠色 B.將用石蕊溶液染成紫色的干燥的紙花直接放入盛滿二氧化碳的集氣瓶中,紙花變紅 C.將空氣中燃著的硫伸入氧氣中,火焰由淡藍色變為藍紫色 D.在滴加酚酞溶液的蒸餾水中再滴加濃氨水,液體由無色變為紅色 組卷:45引用:2難度:0.6 -
8.實驗室里有一包樣品是由氫氧化鈉和氧化銅組成,為了測定其中氧化銅的質量,現將該樣品倒入燒杯中(不考慮實驗中造成的損失),并取100g溶質質量分數為14.6%的稀鹽酸加入燒杯中,充分反應后燒杯中只得到中性溶液,其中溶劑的質量是90.8g,則原混合物中氧化銅的質量為(假設氧化銅溶液為中性)( )
A.4g B.8g C.12g D.16g 組卷:13引用:1難度:0.3
三、簡答題(10分)
-
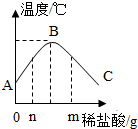 24.將稀鹽酸慢慢滴入裝有氫氧化鈉溶液的燒杯中,用溫度計測出燒杯中溶液的溫度,溶液溫度隨加入稀鹽酸的質量而變化如圖所示:
24.將稀鹽酸慢慢滴入裝有氫氧化鈉溶液的燒杯中,用溫度計測出燒杯中溶液的溫度,溶液溫度隨加入稀鹽酸的質量而變化如圖所示:
①由圖知,稀鹽酸與氫氧化鈉溶液發生的反應是(填“放熱”或“吸熱”)反應。
②從A到B過程中,燒杯中溶液的pH逐漸。B點表示的含義是。
③加入n時溶質有加入鹽酸到m時pH7(大于小于等于)7。組卷:258引用:7難度:0.5
四、綜合應用題(10分)
-
25.以下是甲、乙兩同學對有關鎂與鹽酸反應的系列研究。
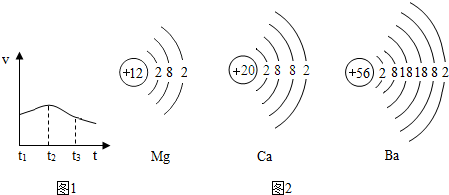
研究一:鎂與鹽酸反應過程中的能量變化以及反應速率的變化:
(1)反應中試管外壁發燙,說明鎂與稀鹽酸反應是反應(填“吸熱”或“放熱”)。
(2)實驗測得鎂片產生氣體的速率(v)與時間(t)的關系如圖1所示,則t1~t2時間內反應速率逐漸加快的主要原因是。
研究二:反應后所得溶液的酸堿性探究:
(3)甲同學反應后用pH試紙測定試管中溶液的酸堿性,發現pH小于7,說明甲同學所得溶液呈性(選填“酸”“堿”或“中”)。
甲同學:猜想Ⅰ:稀鹽酸過量,使溶液pH小于7;猜想Ⅱ:氯化鎂溶液pH小于7.為驗證猜想,甲同學需測定溶液的酸堿性,實驗表明該溶液顯弱酸性。
(4)乙同學重復甲同學實驗時,發現反應后所得試管中溶液pH大于7.發現實驗與甲同學實驗不同的是,反應后的試管中鎂條有剩余。乙同學猜想可能是鎂與熱水反應生成了堿性物質。乙同學為驗證猜想,在滴有兩滴酚酞的熱水中放入一段打磨過的鎂條,觀察到溶液很快變為紅色,同時還觀察到鎂條表面有氣體生成,收集并點燃該氣體,發現能燃燒,請根據實驗現象寫出鎂與水反應的化學反應方程式。
(5)金屬氯化物溶液pH大小與金屬的活動性有關,如氯化鈉溶液顯中性,氯化鎂溶液顯弱酸性,則氯化鉀溶液顯性。
(6)活潑金屬能與水在一定條件下反應。實驗發現鈉與冷水劇烈反應,產生大量的氣體。由此可見金屬與水反應與金屬的活動性順序(填“有關”或“無關”)。
研究三:金屬活動性強弱與原子結構的關系:
如圖2為鎂原子、鈣原子和鋇原子結構示意圖。已知其中Ba的活動性最強,據此推測,金屬的活動性除與原子的最外層電子數有關,還與有關。
研究四:確定鎂條的成分:
稱取3.2g表面被氧化的鎂條,放入100g稀鹽酸中恰好完全反應,生成氣體0.2g.求:
(7)此鎂條中金屬鎂的質量。(寫出計算過程,共3分)
(8)反應后所得溶液中溶質的質量分數。(計算結果保留一位小數)組卷:40引用:4難度:0.1


