2021-2022學年甘肅省天水一中高二(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題3分,共81分)
-
1.工業上用鋁土礦(主要成分為Al2O3,含Fe2O3雜質)為原料冶煉鋁的工藝流程如圖:下列敘述不正確的是( )
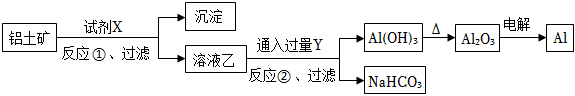
A.試劑X可以是氫氧化鈉溶液 B.反應①過濾后所得沉淀為氧化鐵 C.圖中所示轉化反應包含氧化還原反應 D.反應②的化學方程式為2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3 組卷:287引用:2難度:0.7 -
2.反應A(g)+3B(g)═2C(g)+2D(g)在四種不同情況下的反應速率分別為
①v(A)=0.45mol?L-1?min-1
②v(B)=0.6mol?L-1?s-1
③v(C)=0.4mol?L-1?s-1
④v(D)=0.5mol?L-1?s-1
該反應進行的快慢順序為( )A.④>③>②>① B.④<③=②<① C.①>②>③>④ D.④>③=②>① 組卷:55引用:6難度:0.9 -
3.2017年5月9日,最新發現的第113號、115號、117號和118號元素終于有了中文名稱

根據元素周期律知識,下列預測或說法肯定不合理的是( )A.Nh的最高價氧化物對應的水化物的化學式為H3NhO3是一種強酸 B.Mc的最高價陽離子為Mc5+,氧化性比較弱 C.Og是第七周期中的最后一種元素,其原子序數是所有已發現元素中最大的 D.根據金屬和非金屬的分界線,Ts的中文名稱為“鈿”可能更合理 組卷:74引用:5難度:0.7 -
4.現有W、X、Y、Z四種短周期元素,W分別與X、Y、Z結合生成甲、乙、丙三種化合物,且每個甲、乙、丙分子中均含10個電子,Y和Z化合生成丁,有關物質的轉化關系如圖所示。下列說法正確的是( )
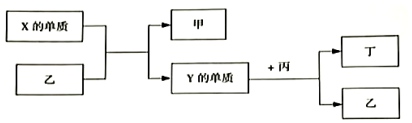
A.原子半徑由小到大的順序是:W<Z<Y<X B.Z的最高價氧化物對應的水化物一定為強酸 C.化合物的沸點由高到低的順序是:乙>甲>丙 D.Y與W、Z都只能形成兩種化合物 組卷:45引用:4難度:0.5 -
5.科學家最近研究出一種環保、安全的儲氫方法,其原理可表示為:NaHCO3+H2
HCOONa+H2O,下列有關說法正確的是( )儲氫釋氫A.儲氫、釋氫過程均無能量變化 B.釋氫過程中,每消耗0.1molH2O放出2.24L的H2 C.1mol固體NaHCO3中含有2NA個離子 D.上述儲氫原理和鋼瓶儲氫原理相同 組卷:7引用:2難度:0.7 -
6.在稀硫酸中加入銅粉,銅粉不溶,再加入下列物質:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,銅粉溶解的是( )
A.只有①② B.只有①②④ C.只有①②③ D.上述任意一種 組卷:214引用:3難度:0.5 -
7.下列既屬于氧化還原反應,又屬于吸熱反應的是( )
A.甲烷(CH4)在O2中的燃燒反應 B.鋁片與稀鹽酸反應 C.Ba(OH)2?8H2O與NH4Cl的反應 D.灼熱的炭與水蒸氣的反應 組卷:16引用:24難度:0.9 -
8.下列有關試劑的保存方法,錯誤的是( )
A.濃硝酸保存在棕色試劑瓶中并放置在陰涼處 B.少量的金屬鈉保存在煤油中 C.液溴應保存在棕色細口瓶,并加水液封 D.新制的氯水通常保存在無色玻璃試劑瓶中 組卷:21引用:6難度:0.9 -
9.若要將1.6 mol甲烷完全和氯氣發生取代反應,并且生成四種取代物的物質的量依次增大0.1 mol,則需要氯氣的物質的量為( )
A.2.5 mol B.4.5 mol C.0.6 mol D.1.5 mol 組卷:17引用:3難度:0.5
一、選擇題(每小題3分,共81分)
-
27.一種新型燃料電池,一極通入空氣,另一極通入丁烷(C4H10)氣體;電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,在熔融狀態下能傳導O2-.下列對該燃料電池的說法正確的是( )
A.在熔融電解質中,O2-移向正極 B.當負極消耗4.48L氣體時,轉移電子5.2mole- C.電子的流動方向:負極經外電路流向正極,再通過內電路流回負極 D.通入丁烷的一極是負極,電極反應為:C4H10-26e-+13O2-═4CO2+5H2O 組卷:20引用:3難度:0.7
二、非選擇題(共19分)
-
28.某課外小組設計的實驗室制取乙酸乙酯的裝置如圖1所示,A中放有濃硫酸,B中放有無水乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液。
已知:①無水氯化鈣可與乙醇形成難溶于水的CaCl2?6C2H5OH。
②有關有機物的沸點:試劑 乙醚 乙醇 乙酸 乙酸乙酯 沸點/℃ 34.7 78.5 118 77.1 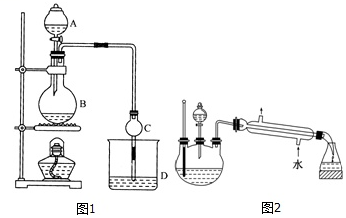
請回答:
(1)濃硫酸的作用是;若用同位素18O示蹤法確定反應產物水分子中氧原子的提供者,寫出能表示18O位置的化學方程式:。
(2)若反應前向D中加入幾滴酚酞,溶液呈色,反應結束后D中的現象是。
(3)采用分液法從D中分離出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入無水氯化鈣,分離出;再加入無水硫酸鈉除去水,然后進行(填操作名稱),以得較純凈的乙酸乙酯。
(4)上述實驗中飽和碳酸鈉溶液的作用是(填字母代號)。
A.反應掉乙酸和乙醇
B.反應掉乙酸并吸收部分乙醇
C.乙酸乙酯在飽和碳酸鈉溶液中的溶解度比在水中的更小,有利于分層析出
D.加速酯的生成,提高其產率
(5)另一化學課外小組對上述實驗進行了改進,設計了圖2所示的裝置,利用濃硫酸、乙醇、乙酸制取乙酸乙酯(鐵架臺、鐵夾、加熱裝置均已略去)與圖1所示裝置相比,此裝置的主要優點有(寫出一條即可)。組卷:109引用:3難度:0.6


