2020-2021學年四川省南充市高二(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括16小題,每小題3分,共48分。每小題只有一個選項符合題意)
-
1.下列說法錯誤的是( )
A.水能、風能、生物質能是可再生能源,煤、石油、天然氣是不可再生能源 B.“冰,水為之,而寒于水”,說明相同質量的水和冰相比較,冰的能量低 C.同溫同壓下,4Al(s)+3O2(g)=2Al2O3(s)在常溫和點燃條件下的ΔH不同 D.反應物和生成物具有的總能量的高低,決定了該反應是放熱還是吸熱反應 組卷:4引用:3難度:0.6 -
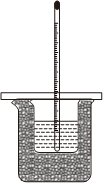 2.如圖為用稀鹽酸和稀NaOH溶液測定中和熱的裝置,下列有關說法錯誤的是( )
2.如圖為用稀鹽酸和稀NaOH溶液測定中和熱的裝置,下列有關說法錯誤的是( )A.該裝置缺少環形玻璃攪拌棒 B.小燒杯與大燒杯口相平 C.將NaOH溶液一次性快速加入盛有稀鹽酸的小燒杯中 D.用稀硫酸和稀氨水替換上述藥品實驗,所測中和熱結果相同 組卷:13引用:2難度:0.8 -
3.下列有關電池的說法錯誤的是( )
A.手機中用的鋰離子電池屬于二次電池 B.甲醇燃料電池可把化學能轉化為電能 C.銅鋅原電池工作時,電子沿外電路從銅電極流向鋅電極 D.鉛蓄電池使用一段時間后,電解質溶液的酸性減弱,導電能力下降 組卷:12引用:2難度:0.7 -
4.下列事實不能用勒夏特列原理解釋的是( )
A.常溫下將pH=4的醋酸溶液稀釋10倍,pH<5 B.SO2被O2氧化為SO3的反應,往往需要使用催化劑 C.利用TiCl4水解制備TiO2時,需加入大量水并加熱 D.向Mg(OH)2懸濁液中滴加FeCl3溶液,有紅褐色沉淀生成 組卷:5引用:1難度:0.7 -
5.實驗室利用下列方案探究影響化學反應速率的因素,有關說法錯誤的是( )
實驗編號 溫度/℃ 酸性KMnO4溶液 H2C2O4溶液 ① 25 4 mL 0.01 mol?L-1 2 mL 0.01 mol?L-1 ② 25 4 mL 0.01 mol?L-1 2mL 0.02 mol?L-1 ③ 50 4 mL 0.01 mol?L-1 2 mL 0.01 mol?L-1 A.實驗中要記錄溶液褪色所需時間 B.實驗①②探究的是濃度對化學反應速率的影響 C.實驗①③探究的是溫度對化學反應速率的影響 D.起始時向①中加入MnSO4固體,不影響反應速率 組卷:17引用:4難度:0.7 -
6.室溫下,某溶液中由水電離出的c(H+)為1×10-12mol/L,下列離子一定不能大量存在的是( )
A.HS- B.CH3COO- C.Fe3+ D.NH4+ 組卷:1引用:1難度:0.7 -
7.將0.2mol/L的KI溶液和0.01mol/L Fe2(SO4)3溶液等體積混合后,取混合液分別進行實驗。下列能說明溶液中存在平衡2Fe3++2I-?2Fe2++I2的是( )
A.滴入硝酸銀溶液產生黃色沉淀 B.加入酸性KMnO4溶液,溶液紫紅色褪去 C.滴入淀粉溶液,溶液變藍色 D.滴入KSCN溶液,溶液變紅色 組卷:33引用:4難度:0.6
【化學--選修3:物質結構與性質】
-
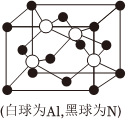 22.氮(N)形成的單質及它形成的化合物有重要的研究和應用價值,回答下列問題:
22.氮(N)形成的單質及它形成的化合物有重要的研究和應用價值,回答下列問題:
(1)已知與CO2互為等電子體,NO+2的結構式為NO+2,中心原子N的雜化方式為。
(2)NH4BF4(四氟硼酸銨)可用作鋁或銅的焊接助熔劑,能腐蝕玻璃,有重要的化工用途。下列說法正確的是。
A.核素15N的中子數為7
B.F元素位于元素周期表p區
C.的空間構型為正四面體形BF-4
D.NH4BF4中存在離子鍵、共價鍵、氫鍵和范德華力
(3)向硫酸銅溶液中通入過量氨氣,得到深藍色溶液,生成配合物[Cu(NH3)4]SO4,其中1mol陽離子[Cu(NH3)4]2+中含有σ鍵數目為。向該深藍色溶液中加入乙醇,得到深藍色晶體,該深藍色晶體為(填化學式)。
(4)請從結構角度解釋HNO3的酸性比HNO2強的原因。
(5)N和Al可組成一種新型半導體材料AlN,其晶胞結構如圖所示,Al原子的配位數為,已知晶胞邊長為apm,NA為阿伏加德羅常數的值,則AlN的密度為g/cm3。組卷:24引用:1難度:0.6
【化學——選修5:有機化學基礎】
-
23.醇A是一種有機合成中間體,用于制增塑劑、除草劑、溶劑等,下面是醇A的相關轉化過程:
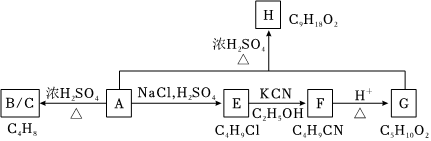
請回答下列問題:
(1)醇A可在濃硫酸加熱條件下得到B、C兩種異構體(不考慮立體異構),C中含有兩個甲基。A的結構簡式為,B的系統命名是。
(2)E中官能團名稱為,由E生成F的反應類型為,F轉變為羧酸G,G的核磁共振氫譜共有組峰。
(3)羧酸G與醇A反應生成甜味物質H的化學方程式。
(4)E在堿性條件下的水解得到A,A可催化氧化為物質Z。A催化氧化為Z的方程式為。
(5)X是E的一種同分異構體,已知X的三個甲基化學環境相同,X在熱的NaOH/醇溶液條件下只得到一種烯烴Y,Y與B、C互為同分異構體。Y的結構簡式為,其中處于同一平面上的原子最多有個。
(6)化合物G的同分異構體中能同時符合下列條件的有種,其中任意一種同分異構體的結構簡式為。
①能發生銀鏡反應
②能催化氧化成醛
③含有手性C原子組卷:8引用:1難度:0.3


