魯科版高三(下)高考題同步試卷:2.2 認識發(fā)生在鹽溶液中的化學反應(01)
發(fā)布:2024/12/9 20:30:1
一、選擇題(共24小題)
-
1.短周期元素W、X、Y、Z的原子序數依次增大,其簡單離子都能破壞水的電離平衡的是( )
A.W2-、X+ B.Y3+、Z2- C.X+、Y3+ D.X+、Z2- 組卷:71引用:49難度:0.7 -
2.下列金屬防腐的措施中,使用外加電流的陰極保護法的是( )
A.水中的鋼閘門連接電源的負極 B.金屬護欄表面涂漆 C.汽車底盤噴涂高分子膜 D.地下鋼管連接鎂塊 組卷:1148引用:57難度:0.9 -
3.把三氯化鐵溶液蒸干灼燒,最后得到的固體產物是( )
A.無水三氯化鐵 B.氫氧化鐵 C.氧化亞鐵 D.三氧化二鐵 組卷:416引用:19難度:0.9 -
4.摩爾濃度相同的三種鹽NaX、NaY和NaZ的溶液,其中pH值依次為8、9、10,則HX、HY、HZ的酸性由強到弱的順序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX 組卷:818引用:52難度:0.9 -
5.銀制器皿日久表面會逐漸變黑,這是生成了Ag2S的緣故.根據電化學原理可進行如下處理:在鋁質容器中加入食鹽溶液,再將變黑的銀器浸入該溶液中,一段時間后發(fā)現黑色會褪去.下列說法正確的是( )
A.處理過程中銀器一直保持恒重 B.銀器為正極,Ag2S被還原生成單質銀 C.該過程中總反應為2Al+3Ag2S═6Ag+Al2S3 D.黑色褪去的原因是黑色Ag2S轉化為白色AgCl 組卷:3026引用:44難度:0.9 -
6.某同學組裝了如圖所示的電化學裝置,電極Ⅰ為Al,其它均為Cu,則( )
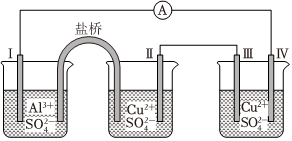
A.電流方向:電極Ⅳ→A→電極Ⅰ B.電極Ⅰ發(fā)生還原反應 C.電極Ⅱ逐漸溶解 D.電極Ⅲ的電極反應:Cu2++2e-═Cu 組卷:2997引用:63難度:0.7 -
7.將分別盛有熔融的氯化鉀、氯化鎂、氧化鋁的三個電解槽串聯,在一定條件下通電一段時間后,析出鉀、鎂、鋁的物質的量之比為( )
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2 組卷:1290引用:78難度:0.7 -
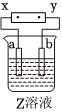 8.如圖中x、y分別是直流電源的兩極,通電后發(fā)現a極板質量增加,b極板處有無色無臭氣體放出,符合這一情況的是( )
8.如圖中x、y分別是直流電源的兩極,通電后發(fā)現a極板質量增加,b極板處有無色無臭氣體放出,符合這一情況的是( ) a極板 b極板 X電極 電解質溶液 A 鋅 石墨 負極 CuSO4 B 石墨 石墨 負極 NaOH C 銀 鐵 正極 AgNO3 D 銅 石墨 負極 CuCl2 A.A B.B C.C D.D 組卷:1000引用:51難度:0.7 -
9.化學與社會、生活密切相關,對下列現象或事實的解釋正確的是( )
選項 現象或事實 解釋 A 用熱的純堿溶液洗去油污 Na2CO3可直接和油污反應 B 漂白粉在空氣中久置變質 漂白粉中的CaCl2與空氣中的CO2反
應生成CaCO3C 施肥時,草木灰(有效成分為K2CO3)不能
與NH4Cl混合使用K2CO3與NH4Cl反應生成氨氣會降低
肥效D FeCl3溶液可用于銅質印刷線路板制作 FeCl3能從含有Cu2+的溶液中置換出銅 A.A B.B C.C D.D 組卷:1548引用:143難度:0.9 -
10.相同物質的量濃度的下列化合物的水溶液,按pH減小順序排列提( )
A.NaHSO4,CH3COONa,NH4Cl,NaNO3 B.NaNO3,CH3COONa,NaHSO4,NH4Cl C.CH3COONa,NaNO3,NH4Cl,NaHSO4 D.NaNO3,CH3COONa,NH4Cl,NaHSO4 組卷:311引用:14難度:0.7
三、解答題(共5小題)
-
 29.化學在環(huán)境保護中起著十分重要的作用,催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
29.化學在環(huán)境保護中起著十分重要的作用,催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
(1)催化反硝化法中,H2能將還原為N2.25℃時,反應進行10min,溶液的pH由7變?yōu)?2。NO-3
①N2的結構式為。
②上述反應的離子方程式為,其平均反應速率υ()為NO-3mol?L-1?min-1。
③還原過程中可生成中間產物,寫出3種促進NO-2水解的方法NO-2。
(2)電化學降解的原理如圖所示。NO-3
①電源正極為(填A或B),陰極反應式為。
②若電解過程中轉移了2mol電子,則膜兩側電解液的質量變化差(Δm左-Δm右)為g。組卷:1284引用:25難度:0.1 -
30.用FeCl3酸性溶液脫除H2S后的廢液,通過控制電壓電解得以再生.某同學使用石墨電極,在不同電壓(x)下電解pH=1的0.1mol/L FeCl2溶液,研究廢液再生機理.記錄如下(a,b,c代表電壓值):
(1)用KSCN溶液檢測處Fe3+的現象是序號 電壓/V 陽極現象 檢驗陽極產物 Ⅰ x≥a 電極附近出現黃色,有氣泡產生 有Fe3+、有Cl2 Ⅱ a>x≥b 電極附近出現黃色,無氣泡產生 有Fe3+,無Cl2 Ⅲ b>x>0 無明顯變化 無Fe3+,無Cl2 .
(2)Ⅰ中Fe3+產生的原因可能是Cl-在陽極放電,生成的Cl2將Fe2+氧化,寫出有關反應:.
(3)由Ⅱ推測,Fe3+產生的原因還可能是Fe2+在陽極放電,原因是Fe2+具有性.
(4)Ⅱ中雖未檢驗處Cl2,但Cl-在陽極是否放電仍需進一步驗證.電解pH=1的NaCl溶液做對照試驗,記錄如下:
①NaCl溶液的濃度是序號 電壓/V 陽極現象 檢驗陽極產物 Ⅳ a>x≥c 無明顯變化 有Cl2 Ⅴ c>x≥b 無明顯變化 無Cl2 mol/L.
②Ⅳ中檢驗Cl2的實驗方法:
③與Ⅱ對比,得出的結論(寫出兩點):.組卷:510引用:15難度:0.6


