2023-2024學年江蘇省南通市海安高級中學高三(上)第一次月考化學試卷
發布:2024/9/18 10:0:8
一、單項選擇題:共13題,每題3分,共39分。
-
1.化學與生產、生活密切相關。下列說法不正確的是( )
A.煤的氣化、煤的液化和煤的干餾均屬于物理變化 B.用于火箭發動機的碳化硅陶瓷是一種新型無機非金屬材料 C.X射線衍射實驗可用于鑒別晶體與非晶體 D.將鋼鐵閘門與電源負極相連的防腐措施屬于外加電流保護法 組卷:20引用:4難度:0.5 -
2.下列有關說法正確的是( )
A.Na+的結構示意圖為 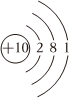
B.中子數為8的氮原子15N C.H2S的球棍模型為 
D.基態S原子核外價電子的軌道表達式為 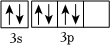 組卷:37引用:3難度:0.8
組卷:37引用:3難度:0.8 -
3.以菱鎂礦(主要成分是MgCO3,含少量FeCO3)為原料制取高純氧化鎂需要經歷酸浸、調pH、過濾、灼燒等操作。下列實驗裝置和原理能達到實驗目的的是( )
A. 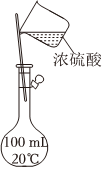 用裝置甲配制稀H2SO4
用裝置甲配制稀H2SO4B. 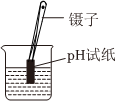 用裝置乙測定溶液的pH
用裝置乙測定溶液的pHC. 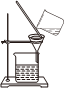 用裝置丙過濾懸濁液
用裝置丙過濾懸濁液D. 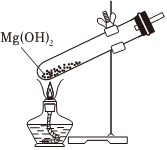 用裝置丁灼燒Mg(OH)2固體組卷:50引用:11難度:0.5
用裝置丁灼燒Mg(OH)2固體組卷:50引用:11難度:0.5 -
4.X、Y、Z、W是原子序數依次增大的短周期元素。X和Y基態原子的s能級電子總數均等于其p能級電子總數,Z的原子最外層電子數是Y原子最外層電子數的2倍,W和X位于同一主族。下列說法正確的是( )
A.第一電離能:I1(X)<I1(W) B.最高價氧化物對應水化物的酸性:Z>W C.原子半徑:r(W)>r(Y)>r(X) D.簡單氣態氫化物的熱穩定性:X>Z 組卷:135引用:5難度:0.5 -
5.閱讀下列材料,完成5~7題:
氨是一種重要的化工原料,主要用于化肥工業,也廣泛用于硝酸、純堿、制藥等工業;合成氨反應中,N2(g)與H2(g)反應生成1molNH3(g)放出46kJ的熱量,實驗室用加熱NH4Cl和Ca(OH)2固體混合物的方法制取少量氨氣,同時生成CaCl2,肼(N2H4)是一種良好的液體燃料。
下列說法正確的是( )A.14N、15N、N3-都屬于氮元素 B.NH3和H2O的中心原子軌道雜化類型不同 C.N2H4分子中的化學鍵均為極性共價鍵 D.CaCl2晶體中存在Ca與Cl2之間強烈的相互作用 組卷:6引用:0難度:0.60
二、非選擇題:共4題,共61分。
-
16.廢棄的鋰離子電池中含有多種金屬元素,需回收處理。檸檬酸因具有酸性和較好的絡合性,可用于浸出金屬離子并得到檸檬酸浸出液。如圖是某小組研究從檸檬酸浸出液中分離出銅并制備堿式碳酸銅[xCuCO3?yCu(OH)2?zH2O]的制備流程。

(1)在“調pH分離銅”的步驟中,理論上銅離子完全沉淀時pH為6.67,本實驗中測得pH=8時銅的沉淀率僅為7.2%,遠小于理論分析結果,可能的原因為。
(2)在“還原法沉銅”的步驟中,利用抗壞血酸(C6H8O6)能有效的將Cu(Ⅱ)還原成金屬Cu。抗壞血酸(C6H8O6)易被氧化為脫氫抗壞血酸(C6H6O6);且受熱易分解。
①抗壞血酸還原Cu(OH)2的離子方程式為:。
②某實驗小組研究了相同條件下溫度對Cu沉淀率的影響。從圖1可以看出,隨著溫度的升高,相同時間內Cu的沉淀率先逐漸增加,在80℃時達到最高點,后略有下降,下降可能的原因是。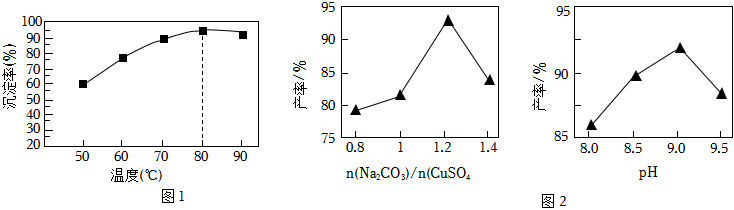
(3)將所得銅粉制備為CuSO4溶液后再制備堿式碳酸銅。已知堿式碳酸銅的產率隨起始n(Na2CO3)與n(CuSO4)的比值和溶液pH的關系如圖2所示。
①補充完整由0.5mol/LCuSO4溶液制取堿式碳酸鋼的實驗方案:向燒杯中加入30mL0.5mol/LNa2CO3溶液,將燒杯置于70℃的水浴中,,低溫烘干,得到堿式碳酸銅。(實驗中可選用的試劑或儀器:0.1mol/LBaCl2溶液、0.1mol/LNaOH溶液、0.1mol/L鹽酸、pH計)
②實驗時發現,若反應時溶液pH過大,所得堿式碳酸銅的產率偏低,但產品中Cu元素含量偏大,原因是。
③稱取9.55g堿式碳酸銅[xCuCO3?yCu(OH)2?zH2O]產品,通入氫氣充分加熱反應后,得到4.8g固體殘留物,同時生成2.2g二氧化碳和2.7g水。則該產品的化學式為。組卷:80引用:3難度:0.4 -
17.金屬鉻耐腐蝕,可做鍍層金屬,Cr(VI)致癌,國家對廢水中Cr含量有嚴格的排放標準。已知:Ksp[Cr(OH)3]=1×10-32;Cr2
+H2O?2O2-7+2H+;氧化性強弱:Cr2CrO2-4>O2-7;CrO2-4
(1)焦亞硫酸鈉除鉻法
①可以選擇焦亞硫酸鈉或亞硫酸鈉(Na2S2O5在酸性條件下分解為、HSO-3)處理含鉻(Ⅵ)廢水,處理費用低。其工藝流程如圖:SO2-3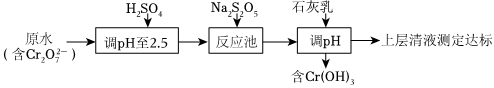
反應池中發生反應的離子方程式。
②其他條件相同,pH<2.5時pH過低,充分反應后除鉻率反而下降,可能的原因是。
③室溫下,加入石灰乳調節pH,當c(Cr3+)<1×10-6mol/L時,pH>。
(2)Fe3O4/納米Fe除鉻法
(i)某研究小組經查閱資料,發現磁鐵礦Fe3O4輔助納米Fe可以降解廢水中的Cr2。為驗證其準確性,進行了如下實驗,相同時間內得到如下實驗結果。O2-7
(ii)依據如下兩個圖示信息,上述實驗3降解Cr2實驗編號 納米Fe(g/L) Fe3O4(g/L) Cr2 實際降解率O2-71 0.05 0 51.4% 2 0 2 7.12% 3 0.05 2 86.67% 效率增大的原因是O2-7。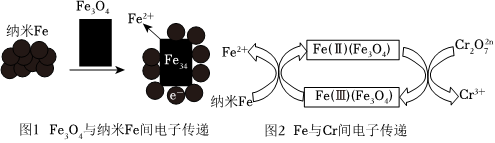
(3)電解除鉻法:
已知:電解除鉻過程中主要反應:Cr2+6Fe2++17H2O=2Cr(OH)3↓+6Fe(OH)3↓+10H+;O2-7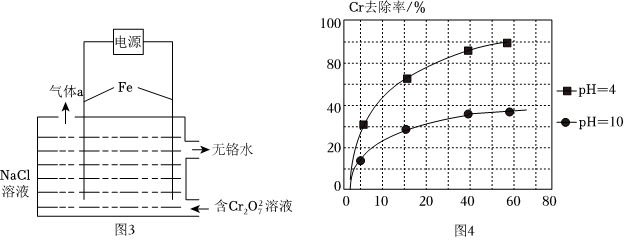
①圖3中氣體a的主要成分是。
②在電解過程中,不同pH、通電時間與Cr元素的去除率關系如圖4所示,其中pH=10比pH=4時Cr元素去除率低的原因可能是。組卷:27引用:2難度:0.5


