2020-2021學年四川省成都市成外、實外、實外西區九年級(下)入學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共14個小題,每小題3分,在每個小題給出的四個選項中,只有一項是符合題目要求的。)
-
1.下列是四川擁有的非物質文化遺產項目,其中涉及化學變化的是( )
A.成都糖畫 B.郫縣豆瓣制作 C.溫江川派盆景盤扎 D.川劇變臉 組卷:92引用:3難度:0.7 -
2.“本以為是青銅,沒想到是王者”,用這句話來形容材料界的超級黑馬石墨烯再合適不過了。石墨烯是從石墨中剝離出來的只有一層碳原子厚度的物質。具有優異的光學、電學和力學特性,被認為是一種革命性的材料。下列關于石墨烯的說法正確的是( )
A.石墨烯是一種新型化合物 B.石墨烯有超強的導電性和導熱性,說明石墨烯是一種金屬材料 C.石墨烯與金剛石的物理性質不同,原因是碳原子排列方式不同 D.石墨烯在空氣中燃燒,產物不可能有一氧化碳 組卷:182引用:1難度:0.8 -
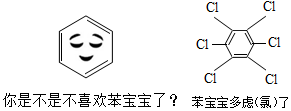 3.近幾年人與人之間的交流方式越來越多樣化,如圖是微信熱傳的“苯寶寶表情包”,苯(化學式C6H6)、六氯苯(化學式C6Cl6)都是重要的化工原料,下列有關說法正確的是( )
3.近幾年人與人之間的交流方式越來越多樣化,如圖是微信熱傳的“苯寶寶表情包”,苯(化學式C6H6)、六氯苯(化學式C6Cl6)都是重要的化工原料,下列有關說法正確的是( )A.苯分子由碳、氫兩種元素組成 B.六氯苯由6個碳原子和6個氯原子構成 C.六氯苯中碳、氯兩種元素的質量比為1:1 D.苯的相對分子質量是78 組卷:42引用:1難度:0.6 -
4.下列有關物質性質與用途對應關系正確的是( )
A.O2密度略大于空氣,可用于供給呼吸 B.干冰升華吸熱,可用于制冷劑 C.氮氣常溫下無色無味,可用作糧食、瓜果的保護氣 D.石墨具有導電性,可用于生產鉛筆芯 組卷:10引用:1難度:0.9 -
5.硒元素具有抗衰老、抑制癌細胞生長的功能,其原子結構示意圖及在元素周期表中的信息如圖,下列說法正確的是( )
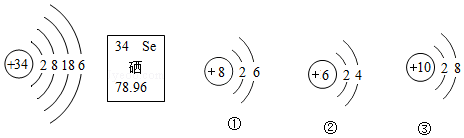
A.圖中化學性質與硒元素相似的是① B.硒元素的相對原子質量是78.96g C.硒原子核內有34個中子 D.硒元素位于元素周期表第六周期 組卷:32引用:1難度:0.6 -
6.下列事實的微觀實質與“氮氣液化”相同的是( )
A.電解水生成氫氣和氧氣 B.濕衣服在陽光下比在陰涼處干得更快 C.香水、汽油要密閉保存 D.將600L CO2氣體裝在8L的滅火器中 組卷:37引用:1難度:0.5
四、(本題包括2個小題,共24分)
-
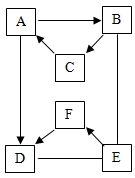 18.(1)有A?F六種物質,已知A、B、C三種固體含有同種金屬元素,A是大理石的主要成分,B能與E反應放出大量的熱。D、E、F含有同種非金屬元素,D、F通常狀況下為氣體。它們的轉化關系如圖(部分產物已略去),圖中“→”表示箭尾的物質可轉化成箭頭的物質;“-”表示兩端的物質能發生化學反應。
18.(1)有A?F六種物質,已知A、B、C三種固體含有同種金屬元素,A是大理石的主要成分,B能與E反應放出大量的熱。D、E、F含有同種非金屬元素,D、F通常狀況下為氣體。它們的轉化關系如圖(部分產物已略去),圖中“→”表示箭尾的物質可轉化成箭頭的物質;“-”表示兩端的物質能發生化學反應。
①寫出物質的化學式A:,F:。
②寫出下列化學方程式:
B與E:,C→A:。
③F→D(填“一定”或“不一定”)是燃燒。
(2)以電石渣[主要成分為Ca(OH)2和CaCO3]為原料制備KClO3的流程如圖。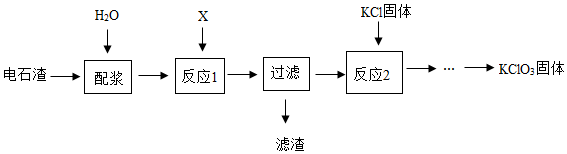
①配漿前將電石渣粉碎,其目的是。
②反應1的產物中含有Ca(ClO3)2,則氣體單質X為(填序號)。
A.O2
B.H2
C.Cl2
③寫出反應2涉及的化學方程式:。組卷:18引用:1難度:0.5
五、(本題有1個小題,共13分)
-
19.鐵及其化合物在生產生活中有廣泛的應用。
一、鐵的應用和防護
(1)鐵銹主要成分是Fe2O3?nH2O,鐵生銹主要與空氣中的有關。
(2)如圖實驗說明NaCl在鐵生銹中的作用是。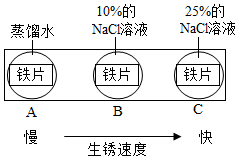
(3)鐵生銹的次要過程: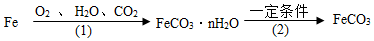 寫出Fe轉化為FeCO3?nH2O的化學方程式 。
寫出Fe轉化為FeCO3?nH2O的化學方程式 。
(4)為防止鐵生銹,可對鐵制品“發藍”處理,在表面生成致密氧化物(其中Fe、O元素質量比為21:8)保護膜,該氧化物的化學式為。
二、鐵銹組分的確定
某鐵銹成分為Fe2O3?xH2O和FeCO3。為確定其組成,興趣小組稱取此鐵銹樣品25.4g,在科研人員的指導下進行實驗。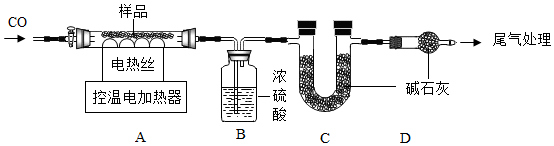
資料:①Fe2O3?xH2O在110℃分解為Fe2O3和H2O,FeCO3在282℃分解為FeO和CO2。
②溫度高于500℃時鐵的氧化物才能被CO還原。
③濃硫酸具有吸水性,堿石灰能吸收水和二氧化碳。
(1)裝配好實驗裝置后,首先要。
(2)停止加熱后仍需繼續通CO,目的是防止生成的鐵被再次氧化和。
(3)控制A裝置中的溫度為300℃對鐵銹進行熱分解,直至A裝置中剩余固體質量不再變化為止,冷卻后裝置B增重3.6g,裝置C增重2.2g。則樣品中Fe2O3?xH2O的x=。
(4)若缺少D裝置,測得樣品中FeCO3的值會(選填“偏大”、“偏小”、“不變”)。
三、煉鐵過程的探究
資料:CO還原赤鐵礦(主要成分Fe2O3)煉鐵的過程大致分為三個階段:
階段1:3Fe2O3+CO2Fe3O4+CO2500-600℃
階段2:Fe3O4+CO3FeO+CO2600-700℃
階段3:FeO+COFe+CO2>700℃
(1)寫出工業上用CO和赤鐵礦煉鐵主要原理的化學方程式。
(2)將上述300℃熱分解后的A裝置中剩余固體繼續分階段升溫,進行CO還原鐵的氧化物煉鐵過程的探究。加熱時測定A中剩余固體質量隨溫度變化的曲線如圖所示。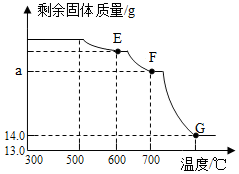
①300℃~500℃裝置A中剩余固體質量沒有發生變化的原因是。
②圖中F點對應的a=。組卷:97引用:2難度:0.2


