2021-2022學年黑龍江省哈爾濱六中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題2分,共50分)
-
1.已知人體體液中存在維持體液pH相對穩定的平衡:CO2+H2O?H2CO3?H++HCO3-,則下列說法不合理的是( )
A.當人體體內的酸堿平衡失調時,血液的pH是診斷疾病的一個重要參數 B.如果CO2進入體液,會使體液的pH減小 C.當強酸性物質進入體液后,平衡向左移動 D.靜脈滴注生理鹽水,體液的pH會有大幅改變 組卷:6引用:2難度:0.7 -
2.下列食品添加劑中,其使用目的與反應速率有關的是( )
A.抗氧化劑 B.調味劑 C.著色劑 D.增稠劑 組卷:1716引用:89難度:0.8 -
3.下列事實不屬于鹽類水解應用的是( )
A.明礬、氯化鐵晶體常用于凈水 B.實驗室通常在HCl氣氛中加熱MgCl2?6H2O制MgCl2 C.用TiCl4和大量水反應,同時加熱制備TiO2 D.實驗室保存FeCl2溶液時常加入Fe粉 組卷:58引用:2難度:0.7 -
4.下列離子方程式中,屬于水解反應的是( )
A.HCOOH+H2O?HCOO-+H3O+ B.CO2+H2O? +H+HCO-3C. +H2O?CO2-3+OH-HCO-3D.HS-+H2O?S2-+H3O+ 組卷:953引用:127難度:0.5 -
5.下列事實不能用勒夏特列原理解釋的是( )
A.合成氨工業上增大壓強以提高反應物的轉化率 B.黃綠色的氯水光照后顏色變淺 C.由H2、I2蒸氣、HI組成的平衡體系加壓后顏色變深 D.在含有Fe(SCN)2+的紅色溶液中加鐵粉,振蕩靜置,溶液顏色變淺或褪去 組卷:36引用:7難度:0.7 -
6.1913年德國化學家哈伯發明了以低成本制造大量氨的方法,從而滿足了當時日益增長的人口對糧食的需求.下列是哈伯法的流程圖,其中為提高原料轉化率而采取的措施是( )

A.①②③ B.②④⑤ C.①③⑤ D.②③④ 組卷:275引用:29難度:0.7 -
7.下列說法不正確的是( )
A.在其他外界條件不變的情況下,增大壓強不能增大活化分子的百分數 B.NH4Cl(s)═NH3(g)+HCl(g)室溫下不能自發進行,說明該反應的△H<0 C.加入合適的催化劑能降低反應的活化能,但不能改變反應的焓變 D.配制FeCl3溶液時,將FeCl3固體溶于鹽酸中,然后再用水稀釋到所需的濃度 組卷:29引用:2難度:0.7 -
8.下列依據熱化學方程式得出的結論正確的是( )
A.已知2C(s)+2O2(g)═2CO2(g)△H=a kJ?mol-1,2C(s)+O2(g)═2CO(g)△H=b kJ?mol-1,則a>b B.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,則含1mol NaOH的稀溶液與足量稀醋酸完全中和,放出的熱量等于57.3kJ C.已知P(白磷,s)═P(紅磷,s)△H<0,則白磷比紅磷穩定 D.已知H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1向密閉容器中加入2mol H2和2mol I2(g),充分反應后放出的熱量小于2a kJ 組卷:44引用:4難度:0.7 -
9.下列驗證HClO是弱電解質的實驗設計錯誤的是( )
A.25℃時,用pH試紙測0.01mol?L-1HClO的pH大于2 B.25℃時,用pH計測NaClO溶液pH,測得pH=9.12 C.25℃時,若測得HClO溶液pH=a,取該溶液10.0mL,加蒸餾水稀釋至100.0mL,測得pH<a+1 D.濃度相同的NaOH溶液分別與等體積,pH相同的次氯酸、鹽酸恰好反應,前者消耗的NaOH溶液的體積多 組卷:6引用:1難度:0.6
二、簡答題(共50分)
-
28.已知常溫下部分弱電解質的電離平衡常數如表:
(1)常溫下,物質的量溶度相同的三種溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的順序是化學式 HF HClO H2CO3 NH3?H2O 電離常數 6.8×10-4 4.7×10-8 K1=4.3×10-7
K2=5.6×10-11Kb=1.7×10-5 (填序號)。
(2)25℃時,pH=4的NH4Cl溶液中各離子濃度的大小關系為。
(3)NaClO溶液中的電荷守恒關系為。
(4)向NaClO溶液中通入少量的CO2,所發生的離子方程式為。
(5)25℃下,將pH=11的苛性鈉溶液V1L與pH=1的稀硫酸V2L混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2,則V1:V2=。
(6)25℃時,H2SO3?HSO3-+H+的電離常數Ka=1.0×10-2,則該溫度下NaHSO3的水解常數Kb=;若向NaHSO3溶液中加入少量的I2,則溶液中將c(H2SO3)c(HSO3-)(填“增大”“減小”或“不變”)。組卷:12引用:1難度:0.6 -
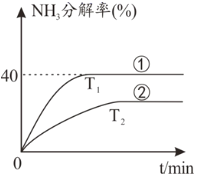 29.氣態含氮化合物是把雙刃劍,既是固氮的主要途徑,也是大氣污染物。氣態含氮化合物及周邊反應是新型科研熱點。回答下列問題:
29.氣態含氮化合物是把雙刃劍,既是固氮的主要途徑,也是大氣污染物。氣態含氮化合物及周邊反應是新型科研熱點。回答下列問題:
(1)恒容密閉容器中,在Ni作催化劑條件下,NH3分解反應如下:2NH3(g)?N2(g)+3H2(g),不同溫度下,NH3分解率隨時間變化如圖所示,T1T2;v正=k正?c2(NH3),v逆=k逆?c(N2)?c3(H2),NH3的初始濃度為c1,T1時NH3分解反應平衡時k正/k逆=;曲線①②中,k正-k逆值最大的曲線為。
(2)NH2COONH4是尿素生成過程的中間產物,在密閉容器中,發生分解反應NH2COONH4(s)?2NH3(g)+CO2(g)。
表中為不同溫度時測得的化學平衡常數K取負對數值,據此推斷該分解反應的ΔHT/K 298 303 308 313 318 -lgK 3.638 3.150 2.717 2.294 1.877 0(填“>”或“<”);若298K時,從反應開始至反應達平衡狀態時用時tmin,測得平衡時,容器內壓強為pMPa,則用分壓表示的NH3的生成速率v(NH3)。組卷:2引用:1難度:0.5


