魯科版(2019)選擇性必修1《2.4 化學反應條件的優化-工業合成氨》2020年同步練習卷(1)
發布:2024/11/21 15:30:3
-
1.可逆反應3H2(g)+N2(g)?2NH3(g)△H<0,達到平衡后,為了使H2的轉化率增大,下列選項中采用的三種方法都正確的是( )
A.升高溫度,降低壓強,增加氮氣 B.降低溫度,增大壓強,加入催化劑 C.升高溫度,增大壓強,增加氮氣 D.降低溫度,增大壓強,分離出部分氨 組卷:18引用:7難度:0.9 -
2.對于合成氨的反應來說,使用催化劑和施加高壓,下列敘述中正確的是( )
A.都能提高反應速率,都對化學平衡狀態無影響 B.都對化學平衡狀態有影響,都不影響達到平衡狀態所用的時間 C.都能縮短反應達到平衡狀態所用的時間,加壓促進化學平衡正向移動 D.催化劑能縮短反應達到平衡狀態所用的時間,而加壓不能 組卷:23引用:1難度:0.8 -
3.在合成氨時,要使氨的產率增大,又要使化學反應速率增大,可以采取的措施有( )
①減小壓強 ②增大壓強 ③升高溫度 ④降低溫度 ⑤恒溫恒容,再充入N2和H2 ⑥恒溫恒壓,再充入N2和H2 ⑦及時分離產生的NH3 ⑧使用催化劑A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧ 組卷:9引用:2難度:0.5 -
4.下圖所示為工業合成氨的流程圖。有關說法錯誤的是( )
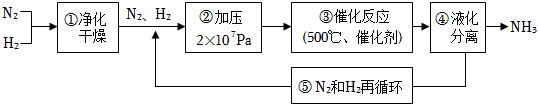
A.步驟①中“凈化”可以防止催化劑中毒 B.步驟②中“加壓”既可以提高原料的轉化率,又可以加快反應速率 C.步驟③、④、⑤均有利于提高原料的轉化率 D.產品液氨除可生產化肥外,還可用作制冷劑 組卷:252引用:17難度:0.7
-
 12.合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響.合成氨反應的化學方程式為N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工業中原料氣N2可從空氣中分離得到,H2可用甲烷或焦炭與水蒸氣反應制得.
12.合成氨生產技術的創立開辟了人工固氮的途徑,對化學工業技術也產生了重大影響.合成氨反應的化學方程式為N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工業中原料氣N2可從空氣中分離得到,H2可用甲烷或焦炭與水蒸氣反應制得.
(1)在一容積固定的密閉容器中注入N2和H2兩種氣體,發生上述反應.在某溫度下達到平衡時,各物質的濃度分別是:c(H2)=9.00mol?L-1,c(N2)=3.00mol?L-1,c(NH3)=4.00mol?L-1,此溫度下該反應的平衡常數K=.
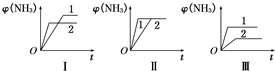
(2)在三個相同容器中各充入1mol N2和3mol H2,在不同條件下反應并達到平衡,氨的體積分數隨時間變化的曲線如圖所示.下列說法中正確的是(填字母).
A.圖Ⅰ可能是不同壓強對反應的影響,且p2>p1
B.圖Ⅱ可能是不同壓強對反應的影響,且p1>p2
C.圖Ⅲ可能是不同溫度對反應的影響,且T1>T2
D.圖Ⅱ可能是同溫同壓下不同催化劑對反應的影響,且催化劑性能1>2
(3)將水蒸氣通過紅熱的炭即可產生水煤氣,化學方程式為:
C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ?mol-1,△S=+133.7J?K-1?mol-1
該反應在常溫下能否自發進行?(填“能”或“不能”).組卷:34引用:4難度:0.5 -
13.科學家一直致力于“人工固氮”的新方法研究。
Ⅰ.合成氨的原理為:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1。
(1)在恒容密閉容器中發生上述反應,下列描述中能說明該反應已達平衡狀態的是。
A.容器內氣體的平均摩爾質量保持不變
B.2v正(NH3)=v逆(N2)
C.容器中氣體的壓強保持不變
D.N2、H2、NH3的物質的量之比為1:2:3
(2)673K、30MPa下,向容積為2.0L的恒容密閉容器中充入0.80mol N2和1.60mol H2,反應經3分鐘達到平衡,此時NH3的體積分數為20%。
①該條件下反應:N2(g)+3H2(g)?2NH3(g)的平衡常數K=(精確到小數點后一位);K越大,表明反應達到平衡時。
A.H2的轉化率一定越高
B.NH3的濃度一定越大
C.正反應進行得越完全
D.化學反應速率越大
②若達平衡后再向該容器中充入0.40mol N2和0.40mol NH3,該平衡將。(填“向正反應方向移動”“向逆反應方向移動”或“不移動”)
Ⅱ.根據“人工固氮”的最新研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生下列反應:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=akJ?mol-1.進一步研究NH3生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如表:
(1)此合成反應的aT/K 303 313 323 NH3的生成量/(10-6 mol) 4.8 5.9 6.0 0,△S0.(填“>”、“<”或“=”)
(2)已知(K為平衡常數):N2(g)+3H2(g)?2NH3(g) K1,2H2(g)+O2(g)═2H2O(l) K2,則N2(g)+3H2O(l)═2NH3(g)+O2(g)的K=32。(用K1、K2表示)組卷:2引用:1難度:0.4


