2021-2022學年陜西省寶雞市金臺區高二(下)期末化學試卷
發布:2024/12/27 0:30:3
一、選擇題(本題1-15題每題2分,16-23題每題3分,共54分,每題只有一個正確答案)
-
1.2022年4月16日上午十時許,神舟十三號載人飛船在外太空出差六個月后順利返回地球。從空間站返回地球需要經歷脫離軌道、平穩過渡、穿越大氣層和安全著陸等四個過程。下列相關描述不正確的是( )
A.飛船穿越大氣層時會和大氣層摩擦而產生2000℃的高溫,所以飛船的外層由氧化鋁、氮化硅等耐高溫材料組成 B.制造航天服所用的材料主要是有機高分子化合物 C.燃料N2H4是既含有極性鍵又有非極性鍵的非極性分子 D.基態N3-和O2-原子核外電子層排布相同 組卷:5引用:2難度:0.9 -
2.科學家將石墨在氟磺酸中“溶解”制得石墨烯(即單層石墨),該溶解克服了石墨層與層之間的( )
A.范德華力 B.離子鍵 C.共價鍵 D.金屬鍵 組卷:347引用:2難度:0.9 -
3.下列說法或有關化學用語的使用正確的是( )
A.在基態多電子原子中,p軌道電子的能量一定高于s軌道電子的能量 B.基態Mn原子的外圍電子排布圖為 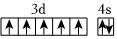
C.碳酸氫鈉的電離方程式:NaHCO3═Na++H++ CO2-3D.基態銅原子的外圍電子排布式為3d94s2 組卷:12引用:2難度:0.7 -
4.某核素核外共有15個不同運動狀態的電子,以下說法正確的是( )
A.該元素的最高價氧化物的水化物為強酸 B.原子中有3種能量不同的電子,9種不同的空間運動狀態 C.若將該原子的電子排布式寫成1s22s22p63s23px2 3py1,它違背了泡利原理 D.該基態原子中能量最高的電子的電子云的形狀為啞鈴形 組卷:50引用:3難度:0.6 -
5.下列物質性質的變化規律,與化學鍵的強弱無關的是( )
A.F2、Cl2、Br2、I2的熔點、沸點逐漸升高 B.HF、HCl、HBr、HI的熱穩定性依次減弱 C.金剛石的硬度、熔點、沸點都高于晶體硅 D.NaF、NaCl、NaBr、NaI的熔點依次降低 組卷:110引用:10難度:0.7 -
6.下列對一些實驗事實的理論解釋正確的是( )
選項 實驗事實 理論解釋 A SO2、H2O分子空間構型均為V形 SO2、H2O中心原子均為sp3雜化 B 白磷為正四面體分子 白磷分子中P-P鍵間的夾角是109.5° C 1體積水可以溶解700體積氨氣 氨是極性分子且有氫鍵的影響 D HF的沸點高于HCl H-F的鍵長比H-Cl 的鍵長短 A.A B.B C.C D.D 組卷:47引用:5難度:0.6 -
7.能說明CS2是非極性分子的事實是( )
A.是對稱的直線型分子 B.CS2沸點高于CO2沸點 C.能在空氣中燃燒 D.分子中存在碳、硫雙鍵 組卷:104引用:2難度:0.8 -
8.下列對HBr、H2、NH3、C2H4中共價鍵存在類型的判斷正確的是( )
A.都有σ鍵,沒有π鍵 B.都有π鍵,沒有σ鍵 C.都既有σ鍵,又有π鍵 D.除C2H4外,都只有σ鍵 組卷:56引用:4難度:0.7 -
9.+3價Co的八面體配合物CoClm?nNH3,中心原子的配位數為6,若1mol配合物與AgNO3作用生成1molAgCl沉淀,則m和n的值是( )
A.m=1、n=5 B.m=3、n=3 C.m=3、n=4 D.m=3、n=5 組卷:11引用:4難度:0.7
二、填空題(本題包括4小題,共46分):
-
26.(1)向盛有CuSO4水溶液的試管里加入氨水,首先形成藍色沉淀,繼續加氨水,沉淀溶解,得到深藍色的透明溶液,加入乙醇時,產生深藍色的晶體。則:
①“首先形成藍色沉淀”對應的離子方程式為。
②實驗過程中生成物中存在配離子(填離子符號)。其配體的中心原子的雜化類型為。
(2)Cu2+可形成多種配合物,與Cu2+形成配合物的分子或離子應具備的結構特征是。
(3)已知NF3與NH3的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,其原因是。組卷:6引用:2難度:0.6 -
27.(1)鋅是一種重要的過渡金屬,鋅及其化合物有著廣泛的應用。鋅在周期表中的
區。
(2)Zn形成金屬晶體,其金屬原子堆積屬于下列模式。
A.簡單立方
B.鉀型
C.鎂型
D.銅型
(3)如圖表示鋅與某非金屬元素X形成的化合物晶胞,其中Zn和X通過共價鍵結合,該化合物的化學式為;該化合物晶體的熔點比干冰高得多,原因是。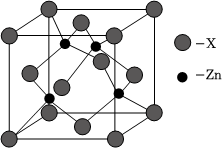
(4)我國科學家發明了高選擇性的二氧化碳加氫合成甲醇的催化劑,其組成為ZnO/ZrO2固溶體。四方ZrO2晶胞如圖所示。晶胞參數為apm、apm、cpm,設ZrO2的相對分子質量為M,則該晶體密度為g?cm-3(寫出表達式)。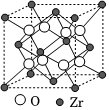 組卷:5引用:2難度:0.5
組卷:5引用:2難度:0.5


