2020-2021學年江蘇省常州市教育學會高二(下)期末化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共12小題,每題3分,共39分。每題只有一個選項最符合題意。
-
1.我國古代煉丹家在煉制丹藥過程中發明了火藥,涉及的主要反應為:S+2KNO3+3C
K2S+N2↑+3CO2↑。下列有關說法正確的是( )點燃A.單質S是共價晶體 B.第一電離能:N>O>K C.電負性:N>O>S D.基態碳原子核外價電子的軌道表示式為  組卷:41引用:1難度:0.7
組卷:41引用:1難度:0.7 -
2.物質的組成和結構決定著物質的性質與變化,下列有關結構和性質的說法正確的是( )
A.CO2分子中存在極性共價鍵,所以CO2為極性分子 B.金屬Li中的金屬鍵比金屬K中的金屬鍵強,所以單質Li的還原性比K強 C.鄰羥基苯甲醛能形成分子內氫鍵,而對羥基苯甲醛能形成分子間氫鍵,所以前者的熔點高于后者 D.乙烯分子中兩個碳原子間以sp2雜化軌道形成的σ鍵較穩定,未雜化的2p軌道形成的π鍵易斷裂,所以易發生加成反應 組卷:53引用:1難度:0.7 -
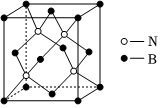 3.超硬材料氮化硼常用于制作刀具和磨料,一種納米立方氮化硼晶體的晶胞結構如圖所示。下列有關該晶體的說法不正確的是( )
3.超硬材料氮化硼常用于制作刀具和磨料,一種納米立方氮化硼晶體的晶胞結構如圖所示。下列有關該晶體的說法不正確的是( )A.其化學式為BN B.與金剛石結構均相似,具有很高的硬度 C.B原子周圍距離最近且相等的N原子有2個 D.X射線衍射是區分晶體和非晶體最可靠的科學方法 組卷:86引用:1難度:0.9 -
4.閱讀下面資料,完成4~5題:鋰電池是由金屬Li或鋰合金為電極材料,使用非水電解質溶液的電池。鋰離子電池是利用鋰離子在正負極間移動的電池,比鋰電池更加安全。
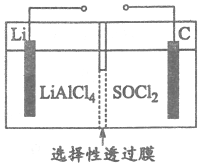 Li-SOCl2電池(如圖)具有很高的比能量(單位質量所能輸出的電能),其中的選擇性透過膜只允許Cl-通過。該電池的總反應為4Li+2SOCl2═4LiCl+SO2↑+S。下列有關該電池的說法正確的是( )
Li-SOCl2電池(如圖)具有很高的比能量(單位質量所能輸出的電能),其中的選擇性透過膜只允許Cl-通過。該電池的總反應為4Li+2SOCl2═4LiCl+SO2↑+S。下列有關該電池的說法正確的是( )A.Li電極為正極 B.放電時Cl-通過選擇性透過膜從右往左遷移 C.C電極發生的電極反應式為2SOCl2-4e-═SO2↑+S+4Cl- D.若有7g Li參加反應,則有1mol電子通過電解質溶液 組卷:11引用:0難度:0.70 -
5.閱讀下面資料,完成4~5題:鋰電池是由金屬Li或鋰合金為電極材料,使用非水電解質溶液的電池。鋰離子電池是利用鋰離子在正負極間移動的電池,比鋰電池更加安全。
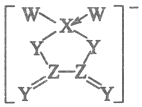 某新型鋰離子電池以鋰鹽作為電解質,其陰離子結構如圖所示。其中W、X、Y、Z為四種同周期的短周期非金屬元素,Y的s軌道和p軌道電子總數相等。下列說法不正確的是( )
某新型鋰離子電池以鋰鹽作為電解質,其陰離子結構如圖所示。其中W、X、Y、Z為四種同周期的短周期非金屬元素,Y的s軌道和p軌道電子總數相等。下列說法不正確的是( )A.簡單氣態氫化物的穩定性:W>Y B.化合物ZW4易溶于苯等有機溶劑 C.該電池的電解質鋰鹽為共價化合物 D.該陰離子中含有極性鍵、非極性鍵和配位鍵 組卷:16引用:0難度:0.50
二、非選擇題:共4題,共61分。
-
16.含硫化合物的污染主要來源于化石燃料的燃燒、硫酸工廠的廢液和煉焦、煉油廠的廢氣。
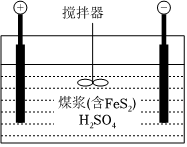
(1)燃煤的電化學脫硫是一種溫和的凈化技術,其基本原理為利用陽極反應產生的羥基自由基(?OH)將燃煤中的含硫物質氧化除去,其裝置示意圖如圖所示。
①將煤打成煤漿加入電解槽的目的是。
②陽極的電極反應式為。
(2)某硫酸廠的廢液中含有一定濃度的硫酸(廢液中微量的重金屬離子可忽略)。為確定中和法處理該廠廢液時生石灰的投料量,現取20.00mL廢液放入錐形瓶中,加入酚酞作指示劑,用的NaOH標準溶液進行滴定。重復上述滴定操作2次。三次實驗消耗NaOH溶液的體0.02000mol?L-1積依次為24.10mL、25.70mL和23.90mL。
①滴定前排除堿式滴定管中氣泡的方法應采用如圖所示操作中的,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。
②該硫酸廠的廢液中H2SO4的物質的量濃度為。
③下列操作(其他操作正確)會造成上述實驗測定結果偏高的有(填字母)。
A.滴定終點時俯視讀數
B.堿式滴定管水洗后未用標準液潤洗
C.錐形瓶水洗后未干燥
D.滴定前滴定管尖嘴處有氣泡,滴定后消失
(3)煉焦、煉油廠的廢氣中含有H2S、H2S溶于水形成的氫硫酸是一種二元弱酸。25℃時,在0.10mol?L-1H2S溶液中,通入HCl氣體或加入NaOH固體以調節溶液pH,溶液pH與c(S2-)關系如圖所示(忽略溶液體積的變化、H2S的揮發)。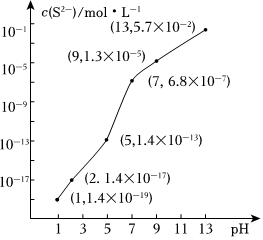
①pH=13時溶液中的c(H2S)+c(HS-)=mol?L-1;
②某溶液含0.010mol?L-1 Fe2+和0.10mol?L-1 H2S,當溶液pH=時,Fe2+開始沉淀。
(已知:Ksp(FeS)=1.4×10-19)組卷:21引用:1難度:0.7 -
17.氮是生命體的重要組成元素,自然界中氮的循環對于生命活動有重要意義。
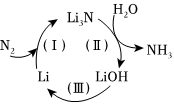
(1)一種利用鋰及其化合物的循環,將空氣中的N2轉化為NH3的過程如圖所示。
①N2和CO是分子量相同的雙原子分子,但液態N2的沸點要(填“>”、“<”或“=”)液態CO。
②寫出轉化(Ⅱ)的化學方程式:。
③轉化(Ⅲ)是電解熔融LiOH,該反應的化學方程式為。
(2)氮肥廠的廢水中氮元素以NH3?H2O、NH3和的形式存在,直接排放會造成水體富營養化。一種電化學氧化處理氨氮廢水的原理是在酸性廢水中加入NaCl進行電解,陽極產生的HClO可氧化氨氮,將其轉化為N2。電解過程中,廢水中初始Cl-濃度對氨氮去除速率及能耗(處理一定量氨氮消耗的電能)的影響關系如圖所示。NH+4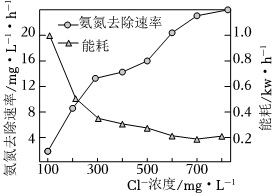
①電解過程中陰極附近溶液的pH(填“升高”、“降低”或“不變”)。
②當Cl-濃度減小時,氨氮去除速率下降,能耗卻增加的原因是。
③保持加入NaCl的量不變,當廢水的pH低于4時,氨氮去除速率也會降低的原因是。組卷:24引用:1難度:0.7


