人教版(2019)選擇性必修1《2.4 化學反應的調控》2023年同步練習卷(11)
發布:2024/8/16 17:0:1
一、選擇題
-
1.下列有關合成氨工業的敘述,可用勒夏特列原理來解釋的是( )
A.使用鐵觸媒,使N2和H2混合氣體有利于合成氨 B.高壓比常壓條件更有利于合成氨的反應 C.500℃左右比室溫更有利于合成氨的反應 D.合成氨時使用催化劑,可提高產率 組卷:85引用:7難度:0.9 -
2.2010 年諾貝爾化學獎授予理查德?赫克等三位科學家,以表彰他們在“鈀催化交叉偶聯”方面的研究.下面關于催化劑的說法正確的是( )
A.催化劑只改變反應的正反應速率 B.催化劑通過升高反應的活化能來加快反應速率 C.催化劑不能改變反應物的轉化率 D.催化劑能夠改變反應的反應熱 組卷:39引用:2難度:0.7 -
3.在恒容密閉容器中,對于工業合成氨反應N2(g)+3H2(g)?2NH3(g)ΔH<0,僅改變一個外界條件,下列對應圖象正確的是( )
A. 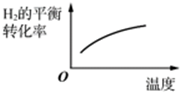
表示溫度對氫氣平衡轉化率的影響B. 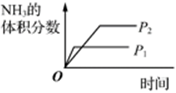
表示壓強對混合體系中NH3體積分數的影響C. 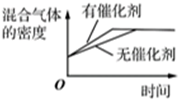
表示催化劑對混合氣體密度的影響D. 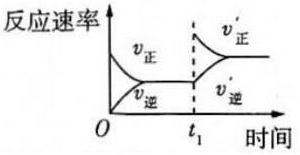
表示t1時刻增大c(N2)對反應速率的影響組卷:6引用:2難度:0.5 -
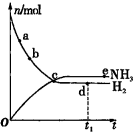 4.對于密閉容器中的反應:N2(g)+3H2(g)?2NH3(g)△H<0,在673K、30MPa下,n(NH3)和n(H2)隨時間t的變化關系如圖所示.下列敘述正確的是( )
4.對于密閉容器中的反應:N2(g)+3H2(g)?2NH3(g)△H<0,在673K、30MPa下,n(NH3)和n(H2)隨時間t的變化關系如圖所示.下列敘述正確的是( )A.a點的正反應速率比b點的大 B.c點反應達到平衡狀態 C.d點和e點處n(N2)不相同 D.其他條件不變時,773K下,反應至t1,n(H2)比圖中d點的值小 組卷:20引用:4難度:0.7
四、解答題
-
12.超音速飛機在平流層飛行時,尾氣中的NO會破壞臭氧層。科學家正在研究利用催化技術將尾氣中的NO和CO轉變成CO2和N2,其反應為:2NO+2CO
2CO2+N2.為了測定在某種催化劑作用下的反應速率,在某溫度下用氣體傳感器測得不同時間的NO和CO濃度如表:催化劑
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):時間(s) 0 1 2 3 4 5 c(NO)
(mol/L)1.00×10-3 4.50×10-4 2.50×10-4 1.50×10-4 1.00×10-4 1.00×10-4 c(CO)
(mol/L)3.60×10-3 3.05×10-3 2.85×10-3 2.75×10-3 2.70×10-3 2.70×10-3
(1)在上述條件下反應能夠自發進行,則反應的△H0(填寫“>”、“<”、“=”)。
(2)前2s內的平均反應速率v(NO)=。
(3)假設在密閉容器中發生上述反應,達到平衡時下列措施能提高NO轉化率的是。
A.選用更有效的催化劑
B.升高反應體系的溫度
C.降低反應體系的溫度
D.縮小容器的體積
(4)在該溫度下,反應的平衡常數K=。組卷:3引用:3難度:0.7 -
13.研究減少CO2排放是一項重要課題。CO2經催化加氫可以生成低碳有機物,主要有以下反應:
反應Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.6 kJ/mol
反應Ⅱ:CH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4 kJ/mol
反應Ⅲ:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3
(1)△H3=kJ/mol。
(2)恒溫恒容條件下,在密閉容器中通入等物質的量的CO2和H2,發生反應 I.下列描述能說明反應 I達到平衡狀態的是(填序號)。
A.反應體系總壓強保持不變
B.容器內的混合氣體的密度保持不變
C.水分子中斷裂2NA個H-O鍵,同時氫分子中斷裂3NA個H-H鍵
D.CH3OH和H2O的濃度之比保持不變
(3)反應 II在某溫度下的平衡常數為0.25,此溫度下,在密閉容器中加入等物質的量的CH3OCH3(g)和H2O(g),反應到某時刻測得各組分濃度如下:
此時v正物質 CH3OCH3(g) H2O(g) CH3OH(g) 濃度/mol?L-1 1.8 1.8 0.4 v逆(填“>”、“<”或“=”),當反應達到平衡狀態時,混合氣體中CH3OH體積分數(CH3OH)%=%。
(4)在某壓強下,反應 III在不同溫度、不同投料比時,CO2的平衡轉化率如圖所示。T1溫度下,將6 mol CO2和12 mol H2充入2 L的密閉容器中,5 min后反應達到平衡狀態,則0~5 min內的平均反應速率v(CH3OCH3)=;KA、KB、KC三者之間的大小關系為。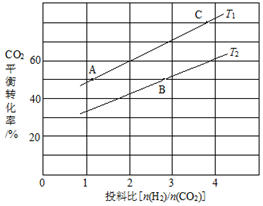
(5)恒壓下將CO2和H2按體積比1:3混合,在不同催化劑作用下發生反應Ⅰ和反應Ⅲ,在相同的時間段內CH3OH的選擇性和產率隨溫度的變化如下圖。其中:CH3OH的選擇性=×100%CH3OH的物質的量反應的CO2的物質的量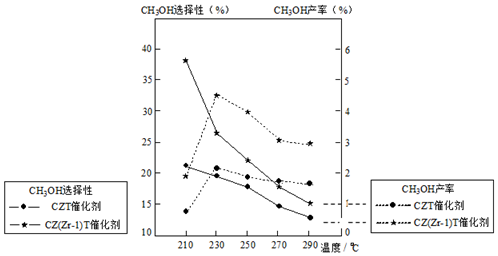
①溫度高于230℃,CH3OH產率隨溫度升高而下降的原因是。
②在上述條件下合成甲醇的工業條件是。
A.210℃B. 230℃C.催化劑CZT D.催化劑CZ(Zr-1)T組卷:54引用:7難度:0.5


