2022-2023學年福建省福州高級中學高二(下)期中化學試卷
發(fā)布:2024/7/8 8:0:10
一、選擇題(本題共10小題,每小題5分,共50分。在每題給出的四個選項中,只有一項符合題目要求。)
-
1.我國古代就掌握了青銅(銅-錫合金)的冶煉、加工技術,制造出許多精美的青銅器;Pb、PbO2是鉛蓄電池的電極材料,不同鉛化合物一般具有不同顏色,歷史上曾廣泛用作顏料,下列物質(zhì)性質(zhì)與用途具有對應關系的是( )
A.石墨能導電,可用作潤滑劑 B.單晶硅熔點高,可用作半導體材料 C.青銅比純銅熔點低、硬度大,古代用青銅鑄劍 D.含鉛化合物顏色豐富,可用作電極材料 組卷:123引用:7難度:0.7 -
2.下列圖①、圖②、圖③所示的原子結(jié)構(gòu)模型中依次符合盧瑟福、道爾頓、湯姆生的觀點的是( )
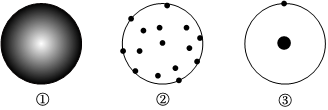
A.①②③ B.③①② C.③②① D.②①③ 組卷:22引用:3難度:0.6 -
3.《Green Chemistry》報道,我國科研工作者發(fā)現(xiàn)了一種在低壓條件下高效電催化還原CO2的新方法,其總反應為NaCl+CO2
CO+NaClO。下列相關化學用語和說法正確的是( )通電A.中子數(shù)為20的氯原子:20Cl B.Na+的結(jié)構(gòu)示意圖: 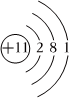
C.CO2分子中C原子雜化方式:sp2 D.NaClO的電子式: 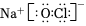 組卷:17引用:2難度:0.5
組卷:17引用:2難度:0.5 -
4.下列不包含d能級的能層是( )
A.L B.M C.N D.O 組卷:50引用:4難度:0.7 -
5.下列說法正確的是( )
A.2p、3p、4p能級的軌道數(shù)依次增多 B.所有非金屬元素都分布在p區(qū) C.最外層電子數(shù)為2的元素都分布在s區(qū) D.元素周期表中從第ⅢB族到第ⅡB族的10個縱列的元素都是金屬元素 組卷:37引用:3難度:0.7 -
6.某短周期元素R的各級電離能數(shù)據(jù)(用I1、I2……表示,單位為kJ?mol-1)如表所示。關于元素R的判斷中正確的是( )
I1 I2 I3 I4 R 740 1500 7700 10500 A.R元素基態(tài)原子的電子排布式為ns1 B.R的最高正價為+4價 C.R元素可能屬于非金屬元素 D.R元素位于元素周期表中第ⅡA族 組卷:58引用:3難度:0.6 -
7.下列化學式所表示的物質(zhì)中,屬于含共價鍵的離子化合物是( )
A.CaCl2 B.H2SO4 C.NH4Cl D.AlCl3 組卷:42引用:1難度:0.5 -
8.下列各組物質(zhì)中,化學鍵類型與晶體類型均相同的是( )
A.NaCl、NaOH B.SiO2、SO2 C.Na2CO3、KClO3 D.H2O2、Na2O2 組卷:16引用:3難度:0.7
二、非選擇題(共3題,共50分)
-
23.中國科學家首次在月球上發(fā)現(xiàn)新礦物,將其命名為“嫦娥石”,“嫦娥石”中包含了Fe、Cu、Ti、Cr、Ni、Mo、N、O等多種元素。
(1)鑒定月球土壤的元素組成,可采用的方法是。
A.光譜分析
B.X-射線衍射分析
(2)在第二周期中,第一電離能比N高的主族元素是。氮原子的電子排布圖表示的狀態(tài)中,能量由低到高的順序是(填序號)。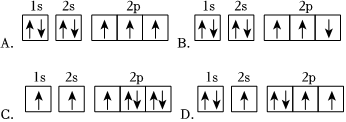 ?
?
(3)已知有關氮、磷的單鍵和三鍵的鍵能(kJ?mol-1)如下表:
從能量角度看,氮以N2、而白磷以P4(結(jié)構(gòu)式可表示為N-N N≡N P-P P≡P 193 946 197 489 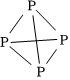 ?)形式存在的原因是 。
?)形式存在的原因是 。
(4)已知NH3分子的鍵角約為107°,而同主族磷的氫化物PH3分子的鍵角約為94°,試用價層電子對互斥模型解釋NH3的鍵角比PH3的鍵角大的原因:。
(5)硒化鋅(ZnSe)是一種重要的半導體材料,其晶胞結(jié)構(gòu)如圖甲所示,已知晶胞邊長為apm,乙圖為甲圖的俯視圖,若原子坐標A為(0,0,0),B為,則D原子坐標為(12,1,12);若該晶胞密度為ρg?cm-3,則阿伏加德羅常數(shù)NA為。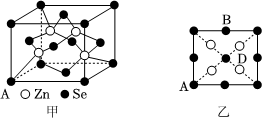 ?組卷:31引用:1難度:0.6
?組卷:31引用:1難度:0.6 -
 24.X、Y、Z、R、M是原子序數(shù)依次增大的五種元素,基態(tài)X原子的s電子數(shù)比p電子數(shù)多3個,Y、Z均位于第二周期且兩元素最外層電子數(shù)之和為11,Z、R同主族,M核外電子有26種運動狀態(tài),請回答下列問題:
24.X、Y、Z、R、M是原子序數(shù)依次增大的五種元素,基態(tài)X原子的s電子數(shù)比p電子數(shù)多3個,Y、Z均位于第二周期且兩元素最外層電子數(shù)之和為11,Z、R同主族,M核外電子有26種運動狀態(tài),請回答下列問題:
(1)化合物XCl3中心原子的雜化軌道類型為;RCl2的立體構(gòu)型為。
(2)H2Z、H2R的沸點分別為100℃、-60.4℃,試解釋其原因:。
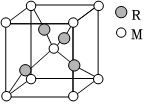
(3)R、M形成的一種化合物晶胞如圖所示。
①該化合物的化學式為。
②若晶胞邊長為apm。列式計算該晶胞的密度ρ=g/cm3。組卷:18引用:1難度:0.7


