2023-2024學年北京師大附中高二(上)期中化學試卷
發布:2024/10/19 11:0:2
一、選擇題(25道小題,共50分,每小題只有1個選項符合題意)
-
1.下列物質中,屬于弱電解質的是( )
A.氨水 B.二氧化硫 C.冰醋酸 D.銅線 組卷:13引用:2難度:0.8 -
2.下列生活中常用的方法,其原理與鹽類的水解反應有關的是( )
A.用明礬凈水 B.用酒精進行環境消毒 C.用3%的H2O2溶液清洗傷口 D.用白醋清洗水壺中的水垢 組卷:40引用:5難度:0.8 -
3.下列溶液肯定顯酸性的是( )
A.含H+的溶液 B.c(H+)>c(OH-)的溶液 C.pH<7的溶液 D.加酚酞顯無色的溶液 組卷:32引用:2難度:0.7 -
4.下列離子方程式中,不屬于水解反應離子方程式的是( )
A.HSO3-+H2O?H2SO3+OH- B.NH4++H2O?NH3?H2O+H+ C.Al3++3H2O?Al (OH)3+3H+ D.HCO3-+H2O?H3O++CO32- 組卷:22引用:2難度:0.5 -
5.25℃時,水中存在電離平衡:H2O?H++OH-△H>0.下列敘述正確的是( )
A.將水加熱,Kw增大,pH不變 B.向水中加入少量NaHSO4固體,c(H+)增大,Kw不變 C.向水中加入少量NaOH固體,平衡逆向移動,c(OH-)降低 D.向水中加入少量NH4Cl固體,平衡正向移動,c(OH-)增大 組卷:164引用:33難度:0.7 -
6.下列事實不能說明HNO2是弱電解質的是( )
A.常溫下NaNO2溶液的pH大于7 B.常溫下0.1mol?L-1的HNO2溶液的pH為2.1 C.pH=11的NaNO2溶液加水稀釋到100倍,pH大于9 D.用HNO2溶液作導電實驗,燈泡很暗 組卷:76引用:9難度:0.7 -
7.下列解釋實際應用的原理表達式中,不正確的是( )
A.用排飽和食鹽水法收集Cl2:Cl2+H2O?H++Cl-+HClO B.熱的純堿溶液堿性增強:CO32-+2H2O?H2CO3+2OH- C.向Mg(OH)2懸濁液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+ D.用TiCl4制備TiO2:TiCl4+(x+2)H2O(過量)?TiO2?xH2O↓+4HCl 組卷:51引用:10難度:0.7 -
8.物質的量濃度相同的下列溶液中,
最小的是( )c(NH+4)A.NH4Cl B.CH3COONH4 C.(NH4)2SO4 D.NH4HSO4 組卷:53引用:1難度:0.8 -
9.痛風病與關節滑液中形成的尿酸鈉(NaUr)有關(NaUr增多,病情加重),其化學原理為:HUr(aq)+Na+ (aq)?NaUr(s)+H+(aq)ΔH<0下列說法不正確的是( )
A.寒冷季節更易誘發關節疼痛 B.大量飲水會增大痛風病發作的可能性 C.飲食中攝入過多食鹽,會加重痛風病病情 D.患痛風病的人應少吃能代謝產生更多尿酸的食物 組卷:401引用:33難度:0.5 -
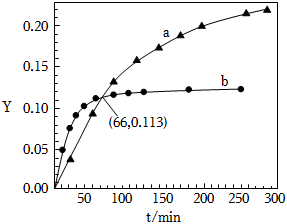 10.已知反應:2CH3COCH3(l) CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分別在0℃和20℃下,測得其轉化分數隨時間變化的關系曲線(Y-t)如圖所示.下列說法正確的是( )催化劑
10.已知反應:2CH3COCH3(l) CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分別在0℃和20℃下,測得其轉化分數隨時間變化的關系曲線(Y-t)如圖所示.下列說法正確的是( )催化劑A.b代表0℃下CH3COCH3的Y-t曲線 B.反應進行到20min末,CH3COCH3的 v(0℃)v(20℃)>1C.升高溫度可縮短反應達平衡的時間并能提高平衡轉化率 D.從Y=0到Y=0.113,CH3COCH2COH(CH3)2的 =1△n(0℃)△n(20℃)組卷:111引用:43難度:0.7
二、填空題(5道小題,共50分)
-
29.印刷電路板廢液主要含CuCl2、FeCl2以及少量的FeCl3等物質,以廢液為原料制備CuSO4,實現資源回收再利用,流程如圖所示。
(1)粗CuSO4溶液的制備: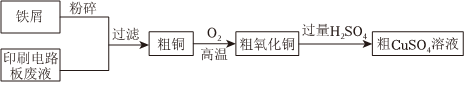
①上述流程中能加快反應速率的措施有。
②加入鐵屑后,印刷電路板廢液中發生的離子反應有。
(2)CuSO4溶液的精制
ⅰ.經檢驗,粗CuSO4溶液含有Fe2+。
ⅱ.向粗CuSO4溶液滴加3%的H2O2溶液,當溶液中Fe2+完全氧化后,加CuCO3粉末調節溶液的pH=4。
ⅲ.將溶液加熱至沸,趁熱減壓過濾,得到精制CuSO4溶液。
①用離子方程式說明加入H2O2溶液的作用:。
②已知:25℃時,Ksp[Cu(OH)2]=2.2×10-20,CuSO4飽和溶液中Cu2+的物質的量濃度為1.41mol?L-1。ⅱ中調節溶液pH=4,請結合計算說明此時Cu2+是否開始沉淀。
(3)工業生產中也可采用電解的方法由Cu制得CuSO4,如圖所示: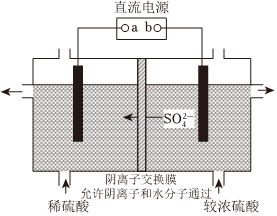
①與直流電源a端相連的電極材料是(填“銅片”a或“石墨”)。
②將進口處較濃硫酸替換成Na2SO4溶液進行實驗,發現得到的CuSO4溶液pH比替換前升高,結合化學用語解釋pH升高的原因是。組卷:7引用:2難度:0.6 -
30.某小組研究了銅片與5.6mol?L-1HNO3反應的速率,實驗現象記錄如表1。
表1實驗 時間段 現象 
0~15min 銅片表面出現極少氣泡 15~25min 銅片表面產生較多氣泡,溶液呈很淺的藍色 25~30min 銅片表面均勻冒出大量氣泡,溶液藍色明顯變深,液面上方呈淺棕色 30~50min 銅片表面氣泡變少
為探究影響該反應速率的主要因素,小組進行如下實驗。
實驗Ⅰ:監測上述反應過程中溶液溫度的變化,所得曲線如圖。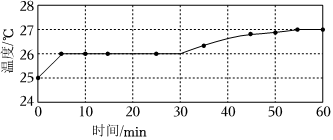
實驗Ⅱ:如圖所示,②~④試管中加入大小、形狀相同的銅片和相同體積的5.6mol?L-1HNO3。結果顯示:②③試管中的反應速率變化不明顯,④試管中的反應速率明顯加快。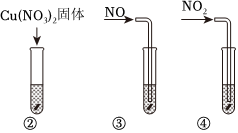
實驗Ⅲ:在試管中加入銅片和5.6mol?L-1HNO3,當產生氣泡較快時,取少量反應液于試管中,檢驗后發現其中含有。NO-2
(1)根據表1中的現象,描述該反應速率隨時間變化的情況。
(2)實驗Ⅰ的結論:溫度升高(填“是”或“不是”)反應速率加快的主要原因。
(3)實驗Ⅱ的結論是。
(4)小組同學查閱資料后推測:該反應由于生成某中間產物而加快了反應速率。請結合實驗Ⅱ、Ⅲ,在如圖方框內填入相應的微粒符號,補全催化機理。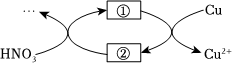
(5)為驗證(4)中猜想,還需補充一個實驗:(請寫出操作和現象)。組卷:17引用:1難度:0.5


