2021-2022學年河南省鄭州第四高級中學(西藏班)高二(下)第二次調研化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題3分,共51分)
-
1.2021年我國取得讓世界矚目的科技成果,化學功不可沒,下列說法錯誤的是( )
A.“嫦娥五號”運載火箭用液氧液氫推進劑,產物對環境無污染 B.我國成功研制出多款新冠疫苗,采用冷鏈運輸疫苗,以防止蛋白質變性 C.“天和核心艙”電推進系統中的腔體采用氮化硼陶瓷屬于新型無機非金屬材料 D.二氧化碳到淀粉的人工全合成技術,可減少向空氣中排放CO2形成酸雨 組卷:27引用:4難度:0.7 -
2.化學史上每一次重大的發現都極大地推動了科學的發展,下列說法正確的是( )
A.丹麥科學家玻爾提出了核外電子分層排布的原子結構模型 B.奧地利科學家泡利發現了基態原子的電子排布遵循能量最低原理 C.德國科學家洪特解釋了一個軌道只允許容納2個電子的原因 D.俄國化學家門捷列夫將元素根據核外電子排布編制了第一張元素周期表 組卷:8引用:1難度:0.7 -
3.對充有氖氣的霓紅燈管通電,燈管發出紅色光。產生這一現象的主要原因( )
A.電子由激發態向基態躍遷時以光的形式釋放能量 B.電子由基態向激發態躍遷時吸收除紅光以外的光線 C.氖原子獲得電子后轉變成發出紅光的物質 D.在電流作用下,氖原子與構成燈管的物質反應 組卷:730引用:47難度:0.5 -
4.現有四種元素的基態原子的電子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p4。則下列有關比較中正確的是( )
A.電負性:④>③>②>① B.原子半徑:④>③>②>① C.第一電離能:④>③>②>① D.最高正化合價:④>③>②>① 組卷:154引用:18難度:0.7 -
5.下列說法正確的是( )
A.某激發態碳原子的電子排布圖: 
B.在元素周期表中,非金屬元素都在p區 C.在第三能層中自旋狀態相同的電子最多有4個 D.原子由激發態轉化成基態時獲得的光譜為發射光譜 組卷:37引用:5難度:0.7 -
6.關于PCl3和CCl4的說法正確的是( )
A.兩種分子的中心原子雜化軌道類型相同 B.鍵角PCl3比CCl4大 C.二者均為非極性分子 D.兩者中的化學鍵都是p-pσ鍵 組卷:33引用:3難度:0.7
二、非選擇題(共49分)
-
19.A、B、C、D為短周期元素且它們的原子序數依次增大,A的核外電子總數與其周期數相同;其中D原子的L電子層中,成對電子與未成對電子占據的軌道數相同,并且無空軌道;B原子的L電子層中未成對電子數與D相同,但還有空軌道。請回答下列問題:
(1)A與其他元素形成的二元共價化合物中,一種化合物分子呈三角錐形,該分子的化學式為,其中心原子的雜化方式為,根據電子云重疊方式的不同,該分子中共價鍵的類型為。
(2)B、C、D的第一電離能由大到小的順序為(用元素符號作答,下同),電負性從大到小的順序為。
(3)已知H-H、Cl-Cl、H-Cl鍵的鍵能分別為436kJ?mol-1、243kJ?mol-1、431kJ?mol-1。試通過鍵能數據估算H2(g)+Cl2(g)═2HCl(g)反應的△H=。組卷:18引用:1難度:0.6 -
20.20、氮是地球上含量較豐富的一種元素,氮的化合物在工業生產和生活中有重要的作用。
(1)消除汽車尾氣污染物中NO的反應平衡常數表達式為:K=。c(N2)?c2(CO2)c2(NO)?c2(CO)
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(g)+O2(g)═2CO(g)△H=-221kJ?mol-1
寫出此反應的熱化學方程式,該反應(填“高溫”或“低溫”)能自發進行。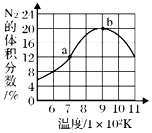
(2)在催化劑作用下,H2可以還原NO消除污染,反應的化學方程式為:2NO(g)+2H2(g)?N2(g)+2H2O(g)△H=-664kJ/mol,將2molNO和1molH2充入一個1L恒容的密閉容器中,經相同時間測得混合氣體N2的體積分數與溫度的關系如圖所示。則低于900K時,N2的體積分數(填“是”或“不是”)對應溫度下平衡時的體積分數,原因是。高于900K時,N2的體積分數降低的可能原因是。(任寫一點)
(3)氨氣是生產氮肥的主要原料,一定溫度下,在體積為1L的密閉容器中充入1molN2和2molH2合成氨反應達到平衡狀態時,測得N2的轉化率為25%,則達平衡時該反應的平衡常數K=。(列出計算式)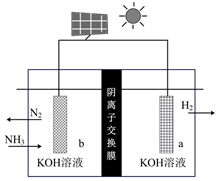
(4)近日,科學家利用電解原理將氨轉化為高純氮氣,其裝置如圖所示。陽極的電極反應式為,電解一段時間后,陰極區的pH(填“不變”、“變大”或“變小”)組卷:42引用:1難度:0.6


