2019-2020學年浙江省杭州市公益中學九年級(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個正確選項,每題3分,共60分)
-
1.下列各組物質中,按單質、氧化物、鹽、有機物順序排列的是( )
A.水銀、水、氯化鉀、甲烷 B.臭氧、氯化鈣、純堿、乙醇 C.鐵、氧化汞、硝酸鎂、鋁粉 D.干冰、三氧化硫、碳酸鈉、葡萄糖 組卷:11引用:3難度:0.9 -
2.歸納和演繹是重要的科學方法。下列歸納和演繹合理的是( )
A.有機物是一類含碳化合物,所以CH4、CO2都是有機物 B.硫酸、鹽酸電離時都能產生H+,所以 電離時能產生H+的化合物是酸 C.金屬Fe、Zn能與酸反應生成氫氣,所以金屬都能與酸反應生成氫氣 D.氧化物是由兩種元素組成,其中一種是氧元素的化合物,所以水是氧化物 組卷:43引用:3難度:0.7 -
3.酸溶液中都含有大量H+,因此不同酸表現出一些共同性質,下列關于鹽酸性質的描述中,不屬于酸的共同性質的是( )
A.能使紫色石蕊試液變為紅色 B.能與氫氧化鈉溶液反應生成水 C.能與硝酸銀溶液反應生成白色沉淀 D.能與鋅反應生成氫氣 組卷:3630引用:67難度:0.9 -
4.如表是固體甲和乙在不同溫度時的溶解度。下列說法中正確的是( )
溫度/℃ 0 20 40 100 甲溶解度/克 0.173 0.165 0.121 0.076 乙溶解度/克 13.3 31.6 63.9 246 A.20℃時甲物質的飽和溶液升高溫度會變為不飽和溶液 B.100℃時乙物質的飽和溶液冷卻到室溫會析出晶體,但溶液仍飽和 C.20℃時,甲溶液的溶質質量分數一定小于乙溶液的溶質質量分數 D.20℃時,100克乙物質加入100克水中,所得溶液的溶質質量分數等于50% 組卷:671引用:58難度:0.9 -
5.我國科研人員成功研制出一種納米纖維催化劑,可將二氧化碳轉化成液體燃料甲醇其微觀示意圖如圖。下列說法正確的是( )
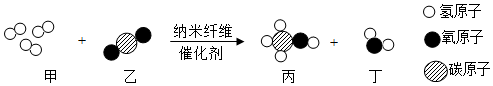
A.甲的相對分子質量為6 B.一個丙分子中含有4個氫原子 C.參加反應的甲與乙的質量比為3:1 D.氫元素的化合價在反應前后沒有發生改變 組卷:267引用:4難度:0.5
三、實驗題(33題第4小題3分,其余每空2分,共49分)
-
16.學習了CO2的相關知識之后,小明對CO2的性質進行三個實驗。
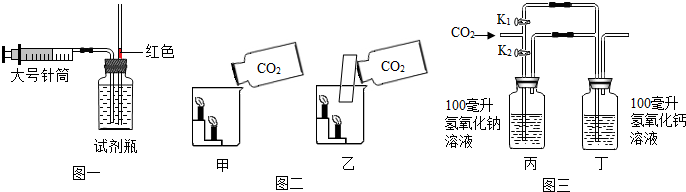
圖一:探究CO2在水中的溶解能力。
①將試劑瓶加滿(選“蒸餾水”或“干凈雨水”),恰好200mL,塞緊橡皮塞;
②用針筒抽取200mLCO2;
③連接裝置,緩慢推動活塞,將CO2注入瓶內。
③當注入CO2氣體體積達到120mL時,紅色油柱開始向上移動。則表明在該條件下,1體積水中能溶解體積CO2。
圖二:驗證CO2的密度比空氣大,應選裝置易成功。
圖三:驗證CO2能否與NaOH、Ca(OH)2反應。
①關閉K1,打開K2,緩緩通入600mL CO2,丙、丁容器中均無明顯現象;
②打開K1,打開K2,繼續通入CO2,丁容器中出現渾濁。
根據上述現象,可推斷CO2。
A.一定能與NaOH反應 B.可能與NaOH反應
C.一定能與Ca(OH)2反應 D.可能與Ca(OH)2反應。組卷:266引用:7難度:0.5
四、計算題(34、35題每題6分,36題5分,共17分)
-
17.某同學用一定質量分數的Na2CO3溶液做“Na2CO3+CaCl2═2NaCl+CaCO3↓”的實驗。其五次實驗結果如下表所示:
根據實驗結果回答下列問題:
(1)哪幾次反應碳酸鈉有剩余(填序號)實驗次數 氯化鈣質量/g 碳酸鈉溶液的質量/g 碳酸鈣的質量/g 1 5.55 200 5 2 11.1 200 10 3 22.2 200 20 4 33.3 250 25 5 55.5 400 X 。
(2)表中X的值是。
(3)試計算碳酸鈉溶液中溶質的質量分數。組卷:580引用:23難度:0.5


