2021-2022學(xué)年云南省玉溪市峨山一中高二(下)月考化學(xué)試卷(3月份)
發(fā)布:2024/4/20 14:35:0
一、單選題(共30小題,每題2分)
-
1.若某電能與化學(xué)能的轉(zhuǎn)化裝置中發(fā)生的反應(yīng)總離子方程式為Cu+2H+=Cu2++H2↑,則關(guān)于該裝置的下列說法正確的是( )
A.該裝置可能是原電池,也可能是電解池 B.該裝置只能是電解池,且金屬銅為該電解池的陽極 C.該裝置只能是電解池,電解質(zhì)溶液不可能是鹽酸 D.該裝置只能是原電池,且電解質(zhì)溶液為硝酸 組卷:12引用:2難度:0.7 -
2.根據(jù)熱化學(xué)方程式:S(s)+O2(g)═SO2(g)△H=a kJ?mol-1(a=-297.2).分析下列說法,其中不正確的是( )
A.S(s)在O2(g)中燃燒的反應(yīng)是放熱反應(yīng) B.S(g)+O2(g)═SO2(g)△H=b kJ?mol-1,則a>b C.1mol SO2(g)所具有的能量低于1 mol S(s)與1 mol O2(g)所具有的能量之和 D.16g固體硫在空氣中充分燃燒,可吸收148.6 kJ的熱量 組卷:53引用:12難度:0.9 -
3.在298K、1.01×105Pa下,將22gCO2通入750mL1mol?L-1NaOH溶液中充分反應(yīng),測得反應(yīng)放出xkJ的熱量。已知該條件下,將1molCO2通入1L2mol?L-1NaOH溶液中充分反應(yīng)放出ykJ的熱量。則CO2與NaOH溶液反應(yīng)生成NaHCO3的熱化學(xué)方程式書寫正確的是( )
A.CO2(g)+NaOH(aq)═NaHCO3(aq) ΔH=-(2y-x)kJ?mol-1 B.CO2(g)+NaOH(aq)═NaHCO3(aq) ΔH=-(2x-y)kJ?mol-1 C.CO2(g)+NaOH(aq)═NaHCO3(aq) ΔH=-(4x-y)kJ?mol-1 D.2CO2(g)+2NaOH(aq)═2NaHCO3(aq) ΔH=-(4x-2y)kJ?mol-1 組卷:58引用:1難度:0.6 -
4.活潑自由基與氧氣的反應(yīng)一直是關(guān)注的熱點。HNO自由基與O2反應(yīng)過程的能量變化如圖所示。下列說法正確的是( )
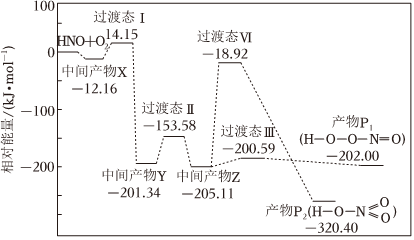
A.該反應(yīng)為吸熱反應(yīng) B.產(chǎn)物的穩(wěn)定性:P1>P2 C.該歷程中最大正反應(yīng)的活化能E正=186.19kJ?mol-1 D.相同條件下,由中間產(chǎn)物z轉(zhuǎn)化為產(chǎn)物的速率:v(P1)<v(P2) 組卷:254引用:24難度:0.8 -
 5.在密閉容器中通入物質(zhì)的量濃度均為0.1mol?L-1的CH4與CO2,在一定條件下發(fā)生反應(yīng):CO2(g)+CH4 (g)?2CO(g)+2H2(g),測得CH4的平衡轉(zhuǎn)化率與溫度及壓強的關(guān)系如圖,下列有關(guān)說法一定正確的是( )
5.在密閉容器中通入物質(zhì)的量濃度均為0.1mol?L-1的CH4與CO2,在一定條件下發(fā)生反應(yīng):CO2(g)+CH4 (g)?2CO(g)+2H2(g),測得CH4的平衡轉(zhuǎn)化率與溫度及壓強的關(guān)系如圖,下列有關(guān)說法一定正確的是( )A.上述反應(yīng)的△H>0 B.壓強p1>p2>p3>p4 C.1100℃該反應(yīng)的平衡常數(shù)為64 D.壓強為p4時,在Y點:v(正)<v(逆) 組卷:58引用:11難度:0.9 -
6.用標(biāo)準(zhǔn)鹽酸滴定未知濃度的NaOH 溶液,下列操作不會引起實驗誤差的是( )
A.用蒸餾水洗凈酸式滴定管后,裝入標(biāo)準(zhǔn)鹽酸進行滴定 B.用酚酞作指示劑滴至紅色剛變無色時立即停止滴定 C.用蒸餾水洗凈錐形瓶后,再用NaOH溶液潤洗,然后裝入NaOH溶液進行滴定 D.將NaOH溶液放入用蒸餾水洗凈的錐形瓶中,加入少量的蒸餾水后進行滴定 組卷:120引用:3難度:0.7 -
7.在Na2S溶液中下列關(guān)系不正確的是( )
A.c(Na+)=2c(HS-)+2c(S2-)+c(H2S) B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) C.c(Na+)>c(S2-)>c(OH-)>c(HS-) D.c(OH-)=c(HS-)+c(H+)+2c(H2S) 組卷:30引用:11難度:0.7 -
8.下列對沉淀溶解平衡的描述正確的是( )
A.反應(yīng)開始時,溶液中各離子濃度相等 B.沉淀溶解達到平衡時,沉淀的速率和溶解的速率相等 C.沉淀溶解達到平衡時,溶液中溶質(zhì)的離子濃度相等,且保持不變 D.沉淀溶解達到平衡時,如果再加入難溶性的該沉淀物,將促進溶解 組卷:242引用:30難度:0.9 -
9.已知298K時下列物質(zhì)的溶度積(單位略)
下列說法正確的是( )CH3COOAg AgCl Ag2CrO4 AgS Ksp 2.3×10-3 1.77×10-10 1.12×10-12 6.7×10-15 A.等體積濃度均為0.02mol?L-1的CH3COONa和AgNO3溶液混合能產(chǎn)生沉淀 B.離子濃度均為0.01mol?L-1的 和Cl-混合溶液中慢慢滴入AgNO3溶液時,CrO2-4先沉淀CrO2-4C.在CH3COOAg懸濁液中加入鹽酸發(fā)生反應(yīng)的離子方程式:CH3COOAg+H++Cl-=CH3COOH+AgCl D.298K時.上述四種飽和溶液的物質(zhì)的量濃度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S) 組卷:147引用:12難度:0.5 -
10.把鋅片和鐵片放在盛有稀食鹽水和酚酞試液混合溶液的玻璃皿中(如圖所示平面圖),經(jīng)過一段時間后,首先觀察到溶液變紅的區(qū)域是( )

A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近 組卷:74引用:28難度:0.9 -
11.觀察電子處于1s軌道的電子云圖,判斷下列說法正確的是( )

A.一個小黑點表示1個自由運動的電子 B.1s軌道的電子云形狀為圓形的面 C.電子在1s軌道上運動像地球圍繞太陽旋轉(zhuǎn) D.1s軌道電子云圖中小黑點的疏密表示電子在某一位置出現(xiàn)機會的多少 組卷:96引用:8難度:0.9
二、非選擇題(共5小題)
-
34.有A、B、C、D四種短周期主族元素,它們的原子序數(shù)依次增大,其中A元素原子核外電子僅有一種原子軌道,也是宇宙中最豐富的元素,B元素原子的核外p電子數(shù)比s電子數(shù)少1,C為金屬元素且原子核外p電子數(shù)和s電子數(shù)相等;D元素的原子核外所有p軌道全滿或半滿.
(1)寫出四種元素的元素符號:A;B;C;D.
(2)寫出C、D兩種元素基態(tài)原子的電子排布圖:CD
(3)寫出B、C兩種元素單質(zhì)在一定條件下反應(yīng)的化學(xué)方程式:.
(4)寫出B元素單質(zhì)和氫化物的電子式,單質(zhì),氫化物.組卷:85引用:7難度:0.3 -
35.計算下列溶液的PH,并將計算結(jié)果填在空格上:
(1)c(H+)=1×10-4 mol/L的溶液;
(2)c(OH-)=1×10-4 mol/L的溶液;
(3)將0.1mol HCl溶于水制成100ml溶液;
(4)將PH=2的HCl溶液和PH=2的H2SO4溶液以體積比3:1混和
(5)將0.23g金屬鈉溶于水并配制成100mL的溶液.組卷:21引用:2難度:0.5


