2015-2016學年甘肅省張掖市高二(上)周測化學試卷
發布:2024/4/20 14:35:0
一、第I卷(選擇題)
-
1.下列有關說法正確的是( )
A.常溫下,向醋酸溶液中加入少量的水,溶液中c(H+)將增大 B.常溫下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的電離程度相同 C.向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不變 D.常溫下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自發進行,則該反應的ΔH>0 組卷:81引用:8難度:0.9 -
2.在硫化氫的水溶液中,存在以下平衡:H2S?HS-+H+、HS-?H++S2-,若使溶液的pH減小,則c(S2-)( )
A.增大 B.減小 C.不變 D.可能增大也可能減小 組卷:19引用:2難度:0.7 -
3.25℃時,向20.00ml的NaOH溶液中逐滴加入某濃度的CH3COOH溶液,滴定過程中,溶液的pH與滴入CH3COOH溶液的體積的關系如圖所示,②點時NaOH溶液恰好被中和,則下列說法中,錯誤的是( )

A.CH3COOH溶液的濃度為0.1mol?L-1 B.圖中點①到點③所示溶液中,水的電離程度先增大后減小 C.點④所示溶液中存在:c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-) D.滴定過程中的某點,會有c(Na+)>c(CH3COO-)=c(OH-)>c(H+) 組卷:324引用:14難度:0.5 -
4.如圖與對應的敘述一定正確的是( )

A.①所示,反應:X(g)+2Y(g)═3Z(g),b的壓強一定比a大 B.②表明合成氨反應是放熱反應,a表示在反應體系中加入了催化劑 C.③所示,t1℃時質量分數均為20%的甲、乙兩種飽和溶液,升溫到t2℃時,兩種溶液中溶質的質量分數不再相等 D.④所示,用水稀釋pH相同的鹽酸和醋酸,Ⅰ表示醋酸,Ⅱ表示鹽酸,且溶液導電性:c>b>a 組卷:44引用:6難度:0.7 -
5.pH相同的氨水、氫氧化鈉和氫氧化鋇溶液,分別用蒸餾水稀釋到原來的X倍、Y倍、Z倍,稀釋后三種溶液的pH同,則X、Y、Z的關系是( )
A.X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z 組卷:77引用:31難度:0.7 -
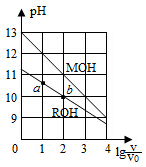 6.濃度均為0.10mol/L、體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨lg的變化如圖所示,下列敘述錯誤的是( )VV0
6.濃度均為0.10mol/L、體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨lg的變化如圖所示,下列敘述錯誤的是( )VV0A.MOH的堿性強于ROH的堿性 B.ROH的電離程度:b點大于a點 C.若兩溶液無限稀釋,則它們的c(OH-)相等 D.當lg =2時,若兩溶液同時升高溫度,則VV0增大c(M+)c(R+)組卷:2218引用:62難度:0.7 -
7.將濃度為0.1mol?L-1HF溶液加水不斷稀釋,下列說法正確的是( )
A.HF的電離平衡正向移動,c(H+)增大 B.HF的電離程度增大,c(H+)、c(F-)增大、c(HF)減小,則 增大c(H+)c(F-)c(HF)C.稀釋過程中,c(OH-)、 均增大c(H+)c(HF)D.溶液的KW、 、pH均不變c(F-)c(H+)組卷:17引用:4難度:0.7 -
8.下列敘述正確的是( )
A.pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀釋100倍后二者的比值幾乎不變 B.由水電離的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 C.1.0×10-3mol/L鹽酸的pH=3,則1.0×10-8mol/L鹽酸的pH=8 D.某溫度下水的離子積為1×10-12,若使pH=1的H2SO4溶液與pH=12的NaOH溶液混合后溶液呈中性,則兩者的體積比為1:10 組卷:3引用:4難度:0.7
二、第II卷(非選擇題)
-
24.按要求寫熱化學方程式:
(1)已知稀溶液中,1mol H2SO4與NaOH溶液恰好完全反應時,放出114.6kJ熱量,寫出表示H2SO4與NaOH反應的中和熱化學方程式.
(2)25℃、101kPa條件下充分燃燒一定量的丁烷氣體放出熱量為Q kJ,經測定,將生成的CO2通入足量澄清石灰水中產生25g白色沉淀,寫出表示丁烷燃燒熱化學方程式.
(3)已知下列熱化學方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+O2(g)═H2O(l)△H3=-285.8kJ/mol12
寫出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的熱化學方程式.組卷:64引用:13難度:0.1 -
25.(1)H2S的燃燒熱△H=-a kJ?mol-1,則H2S燃燒反應的熱化學方程式為
.
(2)已知:高溫下,在密閉容器中用H2還原WO2可得到金屬鎢.當溫度過高時,WO2(s)會轉變為WO2 (g).請根據以下反應:
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ?mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ?mol-1
計算出WO2 (s)?WO2 (g) 的△H=.
(3)工業上常利用天然氣(主要成分為CH4)與CO2進行高溫重整制備CO,反應的化學方程式為:
CH4+CO2=2CO+2H2
已知CH4、H2和CO的燃燒熱分別為890.3kJ?mol-1、285.8kJ?mol-1、283.0kJ?mol-1,則生成1m3(標準狀況)CO所需熱量為.組卷:4引用:2難度:0.3


