2021-2022學年福建省三明一中高二(下)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共20小題,前10題每小題2分,后10題每小題2分,共50分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列表達方式正確的是( )
A.As的電子排布式:[Ar]4s24p3 2p B.N的價電子排布圖 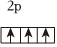
C.Cr原子結構示意圖 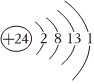
D.Fe2+的價電子排布式為:[Ar]3d54s1 組卷:92引用:4難度:0.6 -
2.下列有關電子云和原子軌道的說法正確的是( )
A.s、p、d能級所含原子軌道數分別為1,3,5 B.s能級的原子軌道呈球形,處在該軌道上的電子只能在球殼內運動 C.p能級的原子軌道呈紡錘形,隨著能層的增加,p能級原子軌道數也增多 D.原子核外的電子像云霧一樣籠罩在原子核周圍,故稱電子云 組卷:14引用:2難度:0.6 -
3.下列化合物分子中既含σ鍵又含π鍵的是( )
A.N2 B.H2O2 C.C2H6O D.CO2 組卷:30引用:3難度:0.8 -
4.下列物質中,具有旋光性的是( )
A.甲烷(CH4) B.乙酸(CH3COOH) C.乙醇(C2H6OH) D.乳酸(CH3CHOHCOOH) 組卷:16引用:3難度:0.9 -
5.下列有關電負性的說法中正確的是( )
A.主族金屬元素的電負性比過渡金屬元素的電負性更小 B.主族元素原子的電負性越大,其第一電離能也越大 C.在元素周期表中,同一周期主族元素電負性從左到右遞增 D.形成化合物時,元素的電負性越大,吸引電子的能力越強,越容易顯示正價 組卷:11引用:2難度:0.6 -
6.對SO2與CO2說法正確的是( )
A.都是直線形結構 B.中心原子都采取sp1雜化 C.硫原子和碳原子上都沒有孤對電子 D.SO2為V形結構,CO2為直線形結構 組卷:174引用:6難度:0.7 -
7.已知某元素+3價離子的電子排布為:1s22s22p63s23p63d5,該元素在周期表中的位置正確的是( )
A.第三周期Ⅷ族,p區 B.第三周期ⅤB族,ds區 C.第四周期Ⅷ族,d區 D.第四周期ⅤB族,f區 組卷:132引用:16難度:0.9 -
8.下列有關苯分子中的描述不正確的是( )
A.碳原子均以sp2雜化軌道形成正六邊形的碳環,鍵角為120° B.每個碳原子還有一個與碳環平面垂直的未參與雜化的2p軌道,相互間以“肩并肩”方式相互重疊,形成一個大π鍵 C.6條碳碳鍵完全等同,共有6個原子處于同一平面 D.每個碳原子的一個sp2雜化軌道分別與6個H原子的1s軌道重疊形成6條σ鍵 組卷:40引用:2難度:0.6
二、非選擇題:本題共6小題,共50分。請根據題目要求作答。
-
25.目前我國主要使用肼(N2H4)作為衛星發射所用燃料。
(1)N2H4可作為火箭發動機的燃料,與氧化劑N2O4反應生成N2和H2O。
已知:
①N2(g)+2O2(g)═N2O4(l)△H=-19.5kJ?mol-1K1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=-534.2kJ?mol-1K2
寫出反應③液體燃料N2H4與液態N2O4反應生成N2和H2O的熱化學方程式:,K1、K2、K3之間的關系:。
(2)若已知下列數據:
試根據表中數據計算出N-H的鍵能:化學鍵 N-N N≡N H-O O=O 鍵能/kJ?mol-1 190 946 462.8 498.8 kJ?mol-1。組卷:19引用:3難度:0.6 -
26.某興趣小組同學設計了一個燃料電池并探究氯堿工業原理的相關問題,裝置如圖1所示,其中乙中X為離子交換膜。請按要求回答相關問題:
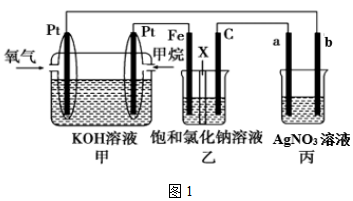
(1)甲裝置中通入CH4的一極為。
(2)乙裝置中X是(陰、陽)離子交換膜,乙池中發生的總反應方程式為。
(3)欲用丙裝置在銅表面鍍一層銀,a、b分別是、(填化學式)。
(4)化學在環境保護中起十分重要的作用,電化學降解法可用于治理水中硝酸鹽污染,電化學降解NO3-的原理如圖2所示: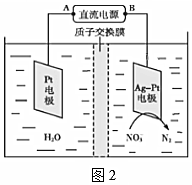
Ag-Pt電極上的電極反應式為。組卷:5引用:1難度:0.5


