人教新版九年級上冊《5.1 質(zhì)量守恒定律&5.2如何正確書寫化學方程式》2023年同步練習卷(20)
發(fā)布:2024/8/1 8:0:9
一、選擇題
-
1.某有機物在氧氣中完全燃燒只生成二氧化碳和水。據(jù)此判斷該有機物組成說法正確的是( )
A.只含有碳、氫元素 B.含有碳、氫、氧三種元素 C.含有碳、氫元素,可能含有氧元素 D.無法確定 組卷:259引用:52難度:0.9 -
2.現(xiàn)將10gA和足量的B混合加熱,A和B發(fā)生化學反應,10gA完全反應后生成8gC和4gD,則參加反應的A與B的質(zhì)量比是( )
A.1:1 B.2:1 C.5:1 D.4:1 組卷:1741引用:72難度:0.7 -
3.把一定質(zhì)量的a、b、c、d四種物質(zhì)放入一密閉容器中,在一定條件下反應一段時間后,測得反應后各物質(zhì)的質(zhì)量如下,下列說法中正確的是( )
物 質(zhì) a b c d 反應前的質(zhì)量(g) 6.4 3.2 4.0 2.8 反應后的質(zhì)量(g) 5.2 X 7.2 2.8 A.a(chǎn)和c是反應物 B.d一定是催化劑 C.X=2.0 D.該反應是化合反應 組卷:2056引用:113難度:0.9 -
4.高鐵酸鉀(K2FeO4)是一種具有氧化、吸附、凝聚、殺菌等功能的新型、高效水處理劑。它與水反應的化學方程式為4K2FeO4+10H2O═4Fe(OH)3↓+8X+3O2↑,則X的化學式為( )
A.K2O B.KOH C.K D.KH 組卷:214引用:42難度:0.9 -
5.下列化學方程式書寫正確的是( )
A.氧化汞加熱分解:HgO=Hg+O2↑ B.鐵絲在氧氣中燃燒:3Fe+2O2 Fe3O4點燃C.鋁片投入稀硫酸中:Al+H2SO4=AlSO4+H2↑ D.碳在氧氣中燃燒:C+O2═CO2 組卷:6引用:2難度:0.6 -
6.在化學反應前后一定發(fā)生改變的是( )
①元素種類 ②原子數(shù)目 ③分子數(shù)目 ④各物質(zhì)的總質(zhì)量
⑤元素質(zhì)量 ⑥原子種類 ⑦分子種類 ⑧物質(zhì)種類.A.③⑤⑦ B.⑦⑧ C.①②⑥ D.④⑧ 組卷:8引用:2難度:0.7
二、填空題
-
18.在實驗室易燃品櫥柜里有一瓶失去標簽的試劑,小紅為探究其成分.進行如下實驗分析:取2.16g該物質(zhì),使其充分燃燒,測知只生成2.16g水和5.28g二氧化碳。請通過計算填空:
(1)該物質(zhì)中含氫元素g,含碳元素g;
(2)若含有氧元素,其質(zhì)量為g。(若不含氧元素,此空不填)組卷:12引用:1難度:0.5
三、解答題
-
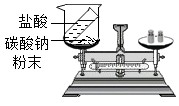 19.回答下列問題:
19.回答下列問題:
(1)按如圖裝置對質(zhì)量守恒定律進行實驗探究,觀察到反應后天平不平衡質(zhì)量守恒定律(填“符合”或“不符合”).
(2)由質(zhì)量守恒定律可知,化學反應前后,一定不變的是(填序號)
①原子種類 ②原子數(shù)目 ③分子種類 ④分子數(shù)目 ⑤元素種類 ⑥物質(zhì)種類
(3)硝酸在工業(yè)生產(chǎn)中有廣泛的應用,工業(yè)上制取硝酸的關(guān)鍵反應為:4NH3+5O24NO+R,其中R化學式為催化劑△.組卷:18引用:3難度:0.3


