2022-2023學年湖北省武漢市重點中學5G聯合體高二(下)期中化學試卷
發布:2024/11/30 1:0:2
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.玻爾理論、量子力學理論都是對核外電子運動的描述方法,根據對它們的理解,下列敘述中正確的是( )
A.因為s軌道的形狀是球形的,所以s電子做的是圓周運動 B.3px、3py、3pz的軌道相互垂直,能量相同 C.各原子能級之間的能量差完全一致,這是量子力學中原子光譜分析的理論基礎 D.同一能層的p軌道電子能量不一定高于s軌道電子能量 組卷:39引用:1難度:0.7 -
2.下列說法正確的是( )
A.p-pσ鍵電子云輪廓圖 
B.基態銅原子的價層電子排布圖: 
C.Fe3+的離子結構示意圖為: 
D.某原子核外電子排布式為ns2np7,它違背了泡利原理 組卷:44引用:6難度:0.7 -
3.下列關于原子核外電子排布與元素在周期表中位置關系的表述中,正確的是( )
A.基態原子的N層上只有一個電子的元素,一定是ⅠA族元素 B.原子的價電子排布為(n-1)d6~8ns2的元素一定是d區元素 C.有三個未成對電子的原子一定屬于主族元素 D.基態原子的價電子排布為(n-1)dxnsy的元素的族序數一定為x+y 組卷:39引用:3難度:0.7 -
4.下列說法中不正確的是( )
A.碳碳雙鍵中σ鍵比π鍵重疊程度大,形成的共價鍵強 B.兩個原子之間形成共價鍵時,最多有1個σ鍵 C.氣體單質中,一定有σ鍵,可能有π鍵 D.一個白磷P4分子中有6個σ鍵 組卷:38引用:1難度:0.6 -
5.下列曲線表示鹵族元素某種性質隨核電荷數的變化趨勢,正確的是( )
A. 
B. 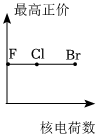
C. 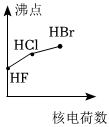
D.  組卷:75引用:22難度:0.8
組卷:75引用:22難度:0.8 -
 6.某種陰離子結構如圖,Q、W、X、Y、Z五種短周期元素的原子半徑依次增大,基態Q原子的電子填充了3個能級,有4對成對電子,Z與其他元素不在同一周期,下列說法不正確的是( )
6.某種陰離子結構如圖,Q、W、X、Y、Z五種短周期元素的原子半徑依次增大,基態Q原子的電子填充了3個能級,有4對成對電子,Z與其他元素不在同一周期,下列說法不正確的是( )A.最簡單氫化物的沸點:Q>X>Y B.Q、W、X的單質分子均為非極性分子 C.最高價氧化物對應水化物的酸性:Z>Y D.同周期中第一電離能小于X的元素有5種 組卷:20引用:1難度:0.6
二、非選擇題:本題共4小題,共55分。
-
18.第四周期某些過渡元素在工業生產中有著極其重要的作用。
(1)鉻是最硬的金屬單質,被稱為“不銹鋼的添加劑”。寫出Cr原子價電子排布圖。
(2)釩廣泛用于催化及鋼鐵工業,被稱之為“工業的味精”。V2O5常用作SO2轉化為SO3的催化劑。SO2分子VSEPR模型是;SO3氣態為單分子,SO3的三聚體環狀結構如圖所示,該結構中S原子的雜化軌道類型為;該結構中S-O鍵長有兩類,一類鍵長約140pm,另一類鍵長約為160pm,較長的鍵為(填圖中字母a或者b)。
(3)鎳是一種優良的有機反應催化劑,Ni能與CO形成正四面體形的配合物Ni(CO)4,其中配原子是C,原因是。
(4)鈦稱之為21世紀金屬,具有一定的生物功能。鈣鈦礦(CaTiO3)晶體是工業獲取鈦的重要原料。CaTiO3晶胞如圖,晶胞參數為anm,晶胞中Ti、Ca、O分別處于頂角、體心、面心位置。Ti與O間的最短距離為nm,與Ti緊鄰的O個數為。
(5)在CaTiO3晶胞結構的另一種表示形式中,Ti處于體心位置,則Ca處于位置,O處于位置。組卷:26引用:1難度:0.5 -
19.氮及其化合物,在工農業生產中作用巨大。
(1)下列有關氮的化合物的說法,正確的是。
A.肼(N2H4)的沸點低于乙烷(C2H6)
B.NH3極易溶于水,原因之一是NH3能夠與水分子形成分子間氫鍵
C.NF3和NH3空間構型均為三角錐形,分子中鍵角:NH3>NF3
D.尿素(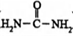 )中σ鍵與π鍵的比例為7:1
)中σ鍵與π鍵的比例為7:1
(2)氮和碳組成的一種新型材料,硬度超過金剛石,其部分結構如圖所示。它的化學式為,它的硬度超過金剛石的主要原因是。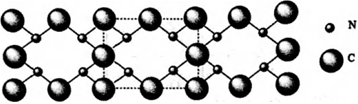
(3)氮化鎵是新型半導體材料,其晶胞結構可看作金剛石晶胞(如圖)內部的碳原子被N原子代替,頂點和面心的碳原子被Ga原子代替。以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標。圖為沿y軸投影的氮化鎵晶胞中所有原子的分布圖。若原子1的原子分數坐標為,則原子2和4的原子分數坐標為(14,34,34)、。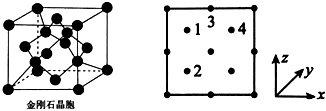
(4)氮化鉬作為鋰離子電池負極材料具有很好的發展前景。它屬于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面體空隙中,晶胞結構如圖所示。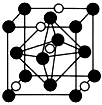
氮化鉬的化學式為,氮化鉬晶胞邊長為apm,晶體的密度ρ=g?cm-3(列出計算式,設NA為阿伏加德羅常數的值)。組卷:29引用:1難度:0.6


