2014-2015學年山東省德州市武城二中高二(上)化學練習卷(六)
發布:2024/12/16 9:0:2
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.化學與科學、技術、社會和環境密切相關.下列說法正確的是( )
A.電解時電解池的陽極一定是陰離子放電 B.反應NH3(g)+HCl(g)═NH4Cl(s)在室溫下可自發進行:則該反應的△H>0 C.其他條件不變,增大壓強,平衡可能移動,但平衡常數一定不變 D.鐵制品表面鑲鋅塊和鐵制品表面鍍錫,都能起到防腐的作用且防腐原理是相同的 組卷:10引用:2難度:0.9 -
2.下列有關敘述正確的是( )
A.需要加熱才能發生的反應一定是吸熱反應 B.強電解質溶液的導電能力一定比弱電解質溶液的強 C.SO3溶于水,其水溶液能導電,故SO3是電解質 D.升高溫度,可提高活化分子百分數,使有效碰撞幾率提高,化學反應速率加快 組卷:40引用:4難度:0.9 -
3.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液 C.使石蕊試液呈紫色的溶液 D.酸與堿恰好完全反應生成正鹽的溶液 組卷:535引用:114難度:0.7 -
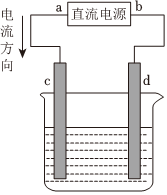 4.如圖是電解 CuCl2溶液的裝置,其中 c、d 為石墨電極。則下列有關的判斷正確的是( )
4.如圖是電解 CuCl2溶液的裝置,其中 c、d 為石墨電極。則下列有關的判斷正確的是( )A.a為負極、b為正極 B.a為陽極、b為陰極 C.電解過程中,d電極質量增加 D.電解過程中,氯離子濃度不變 組卷:129引用:113難度:0.7 -
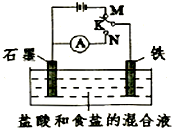 5.用如圖所示裝置進行實驗,下列敘述不正確的是( )
5.用如圖所示裝置進行實驗,下列敘述不正確的是( )A.K與N連接時,鐵被腐蝕 B.K與N連接時,石墨電極產生氣泡 C.K與M連接時,一段時間后溶液的PH增大 D.K與M連接時,初始階段石墨電極的電極反應為4OH--4e-═2H2O+O2↑ 組卷:15引用:3難度:0.7 -
 6.如圖是甲醇燃料電池的結構示意圖。甲醇在催化劑作用下提供質子(H+)和電子,電子經外電路、質子經內電路到達另一極與氧氣反應,電池總反應為2CH3OH+3O2→2CO2+4H2O.下列說法不正確的是( )
6.如圖是甲醇燃料電池的結構示意圖。甲醇在催化劑作用下提供質子(H+)和電子,電子經外電路、質子經內電路到達另一極與氧氣反應,電池總反應為2CH3OH+3O2→2CO2+4H2O.下列說法不正確的是( )A.左電極為電池的負極,a處通入的物質是甲醇 B.正極反應式為:O2+2H2O+4e-→4OH- C.負極反應式為:CH3OH+H2O-6e-→CO2+6H+ D.該電池提供1mole-,消耗氧氣0.25mol 組卷:175引用:14難度:0.7 -
7.下列對化學平衡移動的分析中,不正確的是( )
①已達平衡的反應C(s)+H2O(g)═CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
②已達平衡的反應N2(g)+3H2(g)═2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密閉容器中,發生反應:PCl3(g)+Cl2(g)═PCl5(g)達平衡時,PCl5為0.4mol,如果此時移走1.0molPCl3和0.50molCl2,在相同溫度下再達平衡時PCl5的物質的量應大于0.20mol而小于0.40mol
④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡不會發生移動.A.①④ B.①②③ C.②③④ D.①②③④ 組卷:44引用:4難度:0.9
二、解答題(共5小題,滿分52分)
-
20.實驗室常利用甲醛(HCHO)法測定(NH4)2SO4樣品中氮的質量分數,其反應原理為:4
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定時,1mol (CH2)6N4H+與 l mol H+相當],然后用NaOH標準溶液滴定反應生成的酸.NH+4
某興趣小組用甲醛法進行了如下實驗:
步驟I 稱取樣品1.500g.
步驟II 將樣品溶解在250mL容量瓶中,定容,充分搖勻.
步驟III 移取25.00mL樣品溶液于250mL錐形瓶中,加入10mL 20%的中性甲醛溶液,搖勻、靜置5min后,加入1~2滴酚酞試液,用NaOH標準溶液滴定至終點.按上述操作方法再重復2次.
(1)上述操作步驟Ⅱ是否正確(填“是”或“否”);若不正確,請改正(若正確,此空不填).
(2)根據步驟III填空:
①該實驗用的是50ml滴定管,如果液面處的讀數是a mL,則滴定管中液體的體積(填代號)
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
②堿式滴定管用蒸餾水洗滌后,直接加入NaOH標準溶液進行滴定,則測得樣品中氮的質量分數(填“偏高”、“偏低”或“無影響”).
③錐形瓶用蒸餾水洗滌后,水未倒盡,則滴定時用去NaOH標準溶液的體積(填“偏大”、“偏小”或“無影響”)
④滴定時邊滴邊搖動錐形瓶,眼睛應觀察.
⑤滴定達到終點時現象:.
(3)滴定結果如下表所示:
若NaOH標準溶液的濃度為0.1010mol?L-1,則該樣品中氮的質量分數為滴定
次數待測溶液的
體積/mL[標準溶液的體積/mL 滴定前刻度 滴定后刻度 1 25.00 1.02 21.03 2 25.00 2.00 21.99 3 25.00 0.20 20.20 .組卷:19引用:1難度:0.3 -
21.碳酸鈉,俗名純堿,又稱蘇打,是一種重要的化工基本原料,用途很廣,一般都是利用它的堿性.
(1)碳酸鈉溶液呈堿性的原因是(用離子方程表示).
(2)欲使0.1mol?L-1Na2CO3溶液中c(Na+)=2c(CO32-),應采取的措施是.
A.加少量鹽酸 B.加適量的KOH C.加適量的水 D.加適量的NaOH
(3)為證明鹽的水解是吸熱的,四位同學分別設計了如下方案,其中正確的是.
A.甲同學:在醋酸鈉溶液中滴加2滴酚酞試劑,加熱后紅色加深,說明鹽類水解是吸熱的.
B.乙同學:在鹽酸中加入氨水,混合液溫度上升,說明鹽類水解是吸熱的.
C.丙同學:將硝酸銨晶體溶于水,水溫降低,說明鹽類水解是吸熱的.
D.丁同學:在氨水加入氯化銨固體,溶液的pH變小,說明鹽類水解是吸熱的.
(4)為探究純堿溶液呈堿性是由CO32-引起的,請你用純堿溶液、酚酞、氯化鈣溶液做試劑設計一個簡單的實驗方案.
(5)有資料記載:常溫下,0.1mol?L-1的純堿溶液,發生水解的CO32-離子不超過其總量的10%.請你用pH試紙設計實驗驗證之.組卷:39引用:1難度:0.5


