2020-2021學(xué)年安徽省合肥市新東方學(xué)校高二(下)月考化學(xué)試卷(1)0017
發(fā)布:2025/1/6 7:30:2
一、單項(xiàng)選擇題
-
1.化學(xué)與生活密切相關(guān),下列說(shuō)法錯(cuò)誤的是( )
A.碳酸鈉可用于去除餐具的油污 B.碳酸鋇可用于胃腸X射線造影檢查 C.氫氧化鋁可用于中和過(guò)多胃酸 D.漂白粉可用于生活用水的消毒 組卷:155引用:29難度:0.8 -
2.利用如圖所示裝置測(cè)定中和熱的實(shí)驗(yàn)步驟正確的是( )
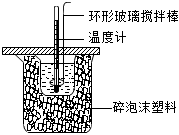
A.為了減小熱量損失,倒入NaOH溶液應(yīng)該多次迅速倒入 B.用套在溫度計(jì)上的環(huán)形玻璃攪拌棒上下輕輕地?cái)噭?dòng) C.燒杯如不蓋硬紙板,不影響測(cè)得的中和熱數(shù)值 D.先用一支溫度計(jì)測(cè)量鹽酸溫度,再用另一支溫度計(jì)測(cè)量氫氧化鈉溶液溫度,并做好記錄 組卷:88引用:3難度:0.5 -
3.下列過(guò)程需要通電后才可以發(fā)生或進(jìn)行的是( )
①電離 ②電泳 ③電解 ④電鍍 ⑤電化學(xué)腐蝕.A.①② B.②③④ C.②③④⑤ D.全部 組卷:30引用:10難度:0.9 -
4.化學(xué)電源在日常生活和高科技領(lǐng)域中都有廣泛應(yīng)用。下列說(shuō)法不正確的是( )

A.圖甲:Zn2+向Cu電極方向移動(dòng),Cu電極附近溶液中H+的濃度增大 B.圖乙:正極的電極反應(yīng)式為Ag2O+2e-+H2O═2Ag+2OH- C.圖丙:鋅筒作負(fù)極,發(fā)生氧化反應(yīng),鋅筒會(huì)變薄 D.圖丁:使用一段時(shí)間后,電解質(zhì)溶液的酸性減弱,導(dǎo)電能力下降 組卷:62引用:6難度:0.7 -
5.已知反應(yīng):2NO(g)+Br2(g)?2NOBr(g)ΔH=-a kJ?mol-1 (a>0),其反應(yīng)機(jī)理如下
①NO(g)+Br2(g)?NOBr2(g) 快
②NO(g)+NOBr2(g)?2NOBr(g) 慢
下列有關(guān)該反應(yīng)的說(shuō)法正確的是( )A.該反應(yīng)的速率主要取決于①的快慢 B.NOBr2是該反應(yīng)的催化劑 C.正反應(yīng)的活化能比逆反應(yīng)的活化能小akJ?mol-1 D.增大Br2(g)濃度能增大活化分子百分?jǐn)?shù),加快反應(yīng)速率 組卷:201引用:29難度:0.9 -
 6.在一體積不變的密閉容器中通入A、B兩種氣體,一定條件下發(fā)生如下反應(yīng):2A(g)+B(g)?2C(g);△H<0.達(dá)到平衡后,只改變一個(gè)條件(X),下列量(Y)的變化一定符合圖中曲線的是( )
6.在一體積不變的密閉容器中通入A、B兩種氣體,一定條件下發(fā)生如下反應(yīng):2A(g)+B(g)?2C(g);△H<0.達(dá)到平衡后,只改變一個(gè)條件(X),下列量(Y)的變化一定符合圖中曲線的是( )
X Y ① A的加入量 B的轉(zhuǎn)化率 ② C的加入量 A的體積分?jǐn)?shù) ③ 再加入He氣 A的轉(zhuǎn)化率 ④ 升高溫度 混合氣體密度 A.① B.② C.③ D.④ 組卷:17引用:5難度:0.7 -
7.天津是我國(guó)研發(fā)和生產(chǎn)鋰離子電池的重要基地.鋰離子電池正極材料是含鋰的二氧化鈷(LiCoO2),充電時(shí)LiCoO2中Li被氧化,Li+遷移并以原子形式嵌入電池負(fù)極材料碳(C6)中,以LiC6表示.電池反應(yīng)為CoO2+LiC6
LiCoO2+C6,下列說(shuō)法正確的是( )放電充電A.放電時(shí),電池的負(fù)極反應(yīng)為L(zhǎng)iC6-e-═Li++C6 B.充電時(shí),電池的正極反應(yīng)為CoO2+Li++e-═LiCoO2 C.羧酸、醇等含活潑氫的有機(jī)物可用作鋰離子電池的電解質(zhì) D.鋰離子電池的比能量(單位質(zhì)量釋放的能量)低 組卷:38引用:7難度:0.7
二、解答題
-
22.常溫下,用NaOH溶液作CO2捕捉劑不僅可以降低碳排放,而且可得到重要的化工產(chǎn)品Na2CO3
(1)若某次捕捉后得到pH=10的溶液,則溶液中c():c(CO2-3)=HCO-3[常溫下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
(2)欲用5LNa2CO3溶液將23.3gBaSO4固體全都轉(zhuǎn)化為BaCO3,則所用的Na2CO3溶液的物質(zhì)的量濃度至少為。[已知:常溫下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液體積的變化)組卷:10引用:1難度:0.7 -
23.鈰(Ce)是地殼中含量最高的稀土元素,是寶貴的戰(zhàn)略資源,在加熱條件下CeCl3易發(fā)生水解,無(wú)水CeCl3可用加熱CeCl3?6H2O和NH4Cl固體混合物的方法來(lái)制備,其中NH4Cl的作用是
。組卷:15引用:1難度:0.7


