2022-2023學年黑龍江省牡丹江一中高二(上)期中化學試卷
發布:2024/9/20 5:0:9
一、選擇題(單項選擇題,每小題2分,共46分)
-
1.下列電解質在水溶液中電離方程式正確的是( )
A.KHSO4═K++ HSO-4B.NH3?H2O═ +OH-NH+4C.NaHCO3═Na++H++ CO2-3D.HClO?H++ClO- 組卷:4引用:1難度:0.5 -
2.已知下列事實,其中與鹽類的水解有關的有( )
①NaHSO4溶液呈酸性;
②長期施用化肥(NH4)2SO4會使土壤酸性增強,發生板結;
③配制CuCl2溶液時,用稀鹽酸溶解CuCl2固體;
④NaHS溶液中c(H2S)>c(S2-);
⑤氯化銨溶液可去除金屬制品表面的銹斑;
⑥蒸干FeCl3溶液,往往得不到FeCl3固體。A.僅①②③⑤ B.僅②③④⑤⑥ C.僅①④⑤⑥ D.僅②③④⑤ 組卷:46引用:3難度:0.6 -
3.NH3的氧化還原反應為4NH3(g)+5O2(g)?4NO(g)+6H2O(g)ΔH<0,下列圖象不正確的是( )
A. 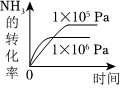
B. 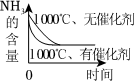
C. 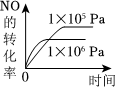
D. 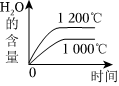 組卷:29引用:3難度:0.5
組卷:29引用:3難度:0.5 -
4.向密閉容器中充入1molHI,發生反應:2HI(g)?H2(g)+I2(g)ΔH>0,達到平衡狀態。該反應經過以下兩步基元反應完成:ⅰ.2HI→H2+2I?ΔH1ⅱ.2I?→I2ΔH2。下列分析不正確的是( )
A.ΔH1>0、ΔH2<0 B.n(HI)+2n(I2)=1mol C.恒溫時,縮小體積,氣體顏色變深,是上述平衡向正反應方向移動導致的 D.恒容時,升高溫度,氣體顏色加深,同時電子發生了轉移 組卷:19引用:5難度:0.5 -
5.向濃度為0.1mol?L-1NaF溶液中不斷加水稀釋,下列各量增大的是( )
A.c(OH-) B.Ka(HF) C.c(F-) D. c(H+)c(HF)組卷:2引用:1難度:0.7 -
6.已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12.在只含有KCl、K2CrO4的混合溶液中滴加0.001mol?L-1的AgNO3溶液,當AgCl與Ag2CrO4共存時,測得溶液中
的濃度是5.000×10-3 mol?L-1,此時溶液中Cl-的物質的量濃度是( )CrO2-4A.1.36×10-5 mol?L-1 B.8.90×10-6 mol?L-1 C.4.45×10-2 mol?L-1 D.1×10-5 mol?L-1 組卷:30引用:5難度:0.7 -
7.由合成氣制備二甲醚的主要原理如下.下列有關說法正確的是( )
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1.A.升高溫度能加快反應②的化學反應速率,提高CH3OCH3產率 B.反應③使用催化劑,△H3減少 C.反應 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.lkJ?mol-1 D.反應③對反應②無影響 組卷:9引用:4難度:0.7 -
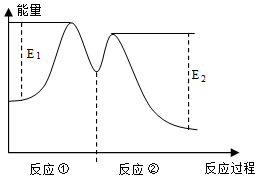 8.一定溫度下,向10mL0.40mol/LH2O2溶液中加入適量FeCl3溶液,不同時刻測得生成O2的體積(已折算為標準狀況)如下表所示。
8.一定溫度下,向10mL0.40mol/LH2O2溶液中加入適量FeCl3溶液,不同時刻測得生成O2的體積(已折算為標準狀況)如下表所示。
資料顯示,反應分兩步進行:①2Fe3++H2O2═2Fe2++O2↑+2H+,②H2O2+2Fe2++2H+═2Fe3++2H2O,反應過程中能量變化如圖所示。下列說法不正確的是( )t/min 0 2 4 6 V(O2)/mL 0 9.9 17.2 22.4 A.0~6min的平均反應速率:v(H2O2)=3.33×10-2mol/(L?min) B.Fe3+的作用是增大過氧化氫的分解速率 C.反應①是吸熱反應、反應②是放熱反應 D.反應2H2O2(aq)═2H2O(l)+O2(g)的ΔH>0 組卷:4引用:1難度:0.5 -
9.下列事實中,能說明MOH是弱堿的有( )
①0.1mol/LMOH溶液可以使酚酞試液變紅
②常溫下,0.1mol/LMOH溶液中c(OH-)<0.1mol/L
③常溫下,0.1mol/LMOH溶液的導電能力比0.1mol/LNaOH溶液弱
④0.1mol/L的MOH溶液與等體積0.1mol/L的鹽酸恰好完全反應
⑤常溫下,往MCl溶液中滴加石蕊溶液,溶液呈淺紅色A.①②③ B.②③④ C.②③⑤ D.③④⑤ 組卷:20引用:2難度:0.7
二、填空題(共54分)
-
26.二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑,實驗室用NH4Cl、鹽酸、NaClO2(亞氯酸鈉)為原料,通過以下過程制備ClO2:
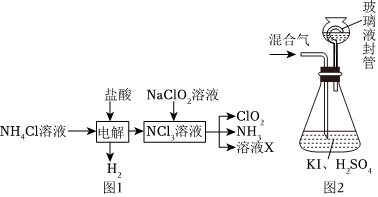
用如圖2裝置可以測定混合氣中ClO2的含量:
Ⅰ.在錐形瓶中加入足量的碘化鉀,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封裝置中加入水,使液面沒過玻璃液封管的管口;
Ⅲ.將一定量的混合氣體通入錐形瓶中吸收;
Ⅳ.將玻璃液封裝置中的水倒入錐形瓶中;
Ⅴ.用0.1000mol?L-1硫代硫酸鈉標準溶液滴定錐形瓶中的溶液(I2+2S2=2I-+S4O2-3),指示劑顯示終點時共用去20.00mL硫代硫酸鈉溶液。O2-6
(1)寫出溶液X中溶質的化學式。
(2)錐形瓶內ClO2與碘化鉀反應的離子方程式為。
(3)玻璃液封裝置的作用是。
(4)V中加入的指示劑通常為,滴定至終點的現象是。
(5)測得混合氣中ClO2的質量為g。
(6)若步驟Ⅱ中液面沒有沒過玻璃液封管的管口,所測結果將(填“偏高”、“偏低”或“無影響”)。組卷:6引用:2難度:0.5 -
27.研究NOx之間的轉化具有重要意義。
(1)已知:N2O4(g)?2NO2(g)ΔH>0
將一定量N2O4氣體充入恒容的密閉容器中,控制反應溫度為T1。
①下列可以作為反應達到平衡的判據是。
A.氣體的壓強不變B.v正(N2O4)=2v逆(NO2)C.K不變
D.容器內氣體的密度不變E.容器內顏色不變
②t1時刻反應達到平衡,混合氣體平衡總壓強為p,N2O4氣體的平衡轉化率為75%,則反應N2O4(g)═2NO2(g)的平衡常數Kp=(對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=p?x(B),p為平衡總壓強,x(B)為平衡系統中B的物質的量分數)。
③反應溫度T1時,c(N2O4)隨t(時間)變化曲線如圖1,畫出0~t2時段,c(NO2)隨t變化曲線。
保持其它條件不變,改變反應溫度為T2(T2>T1),再次畫出0~t2時段,c(NO2)隨t變化趨勢的曲線。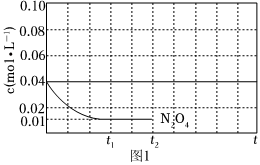
(2)NO氧化反應:2NO(g)+O2(g)═2NO2(g)分兩步進行,其反應過程能量變化示意圖如圖2。
Ⅰ2NO(g)→N2O2(g)ΔH1
ⅡN2O2(g)+O2(g)→2NO2(g)ΔH2
①決定NO氧化反應速率的步驟是(填“Ⅰ”或“Ⅱ”)。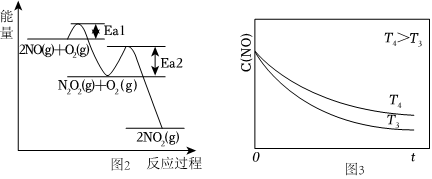
②在恒容的密閉容器中充入一定量的NO和O2氣體,保持其它條件不變,控制反應溫度分別為T3和T4(T4>T3),測得c(NO)隨t(時間)的變化曲線如圖3。
轉化相同量的NO,在溫度(填“T3”或“T4”)下消耗的時間較長,試結合反應過程能量圖(圖2)分析其原因。組卷:474引用:9難度:0.7


