2016-2017學年河北省保定市定州中學高三(上)周練化學試卷(1)
發布:2024/4/20 14:35:0
一、本卷共16小題,每小題3分,共48分.在每小題給出的四個選項中,只有一項是最符合題目要求的.
-
1.下列離子方程式書寫正確的是( )
A.已知電離平衡常數:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,2ClO-+CO2+H2O═2HClO+CO32- B.向Fe(NO3)2和NaBr混合溶液中滴加稀鹽酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O C.在硫酸氫鉀溶液中加入氫氧化鋇溶液至pH=7,Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O D.雙氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O 組卷:7引用:5難度:0.7 -
2.在AlCl3和FeCl3的混合液中,先加入過量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
A.Fe2S3、I2 B.Al(OH)3、I2 C.Fe(OH)3、Al(OH)3 D.FeS、S、Al(OH)3 組卷:32引用:18難度:0.7 -
3.向某NaOH溶液中通入CO2氣體后得溶液M,因CO2通入量的不同,溶液M的組成也不同.若向M中逐滴加入鹽酸,產生的氣體體積V(CO2)與加入鹽酸的體積V(HCl)的關系有下列圖示四種情況,且(2)中有OA<AB,(3)中有OA=AB,(4)中有OA>AB,則下列分析與判斷不正確的是(不計CO2的溶解)( )
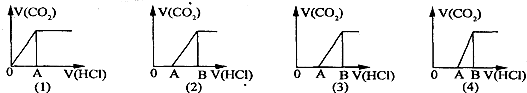
A.圖(1)顯示M中一定有:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) B.圖(2)顯示M中一定有:c(NaHCO3)>c(Na2CO3) C.圖(3)顯示M中一定有:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) D.圖(4)顯示M中的溶質是:NaOH和Na2CO3 組卷:105引用:4難度:0.7 -
4.將羧酸的堿金屬鹽電解可生成烴類化合物,例如:2CH3COOK+2H2O
CH3-CH3↑+2CO2↑+H2↑+2KOH電解
現充分電解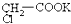 水溶液,并加熱電解后的水溶液,則下列說法中合理的是( )
水溶液,并加熱電解后的水溶液,則下列說法中合理的是( )A.CO2氣體在陰極放出 B.加熱后有不溶于水的油狀物生成 C.混合液蒸干后得到的固體物質是KOH D.混合液蒸干后得到的固體物質是KCl 組卷:9引用:3難度:0.9 -
5.設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.工業采用火法煉銅:Cu2S+O2=2Cu+SO2 每生成2mol銅,反應共轉移4NA個電子 B.7.8g過氧化鈉粉末與足量二氧化硫反應轉移的電子數為0.1NA C.CO2通過Na2O2使其增重bg時,反應中轉移的電子數為 bNA44D.0.01molMg在空氣中完全燃燒生成MgO和Mg3N2,轉移的電子數目為0.02NA 組卷:6引用:3難度:0.9 -
6.微型鈕扣電池在現代生活中有廣泛應用.有一種銀鋅電池,其電極分別是Ag2O和Zn,電解質溶液為KOH,電極反應為:Zn+2OH--2e=ZnO+H2O,Ag2O+H2O+2e=2Ag+2OH-,總反應為:Ag2O+Zn=2Ag+ZnO 根據上述反應式,判斷下列敘述中,正確的是( )
A.在使用過程中,電池負極區溶液pH值增大 B.在使用過程中,電子由Ag2O極經外電路流向Zn極 C.Zn是負極,Ag2O是正極 D.Zn電極發生還原反應,Ag2O電極發生氧化反應 組卷:142引用:9難度:0.7 -
7.由Al、CuO、Fe2O3組成的混合物共10.0g,放入500mL某濃度鹽酸溶液中,混合物完全溶解,當再加入250mL 2.0mol/L的NaOH溶液時,得到的沉淀最多.該鹽酸的濃度為( )
A.0.5 mol/L B.3.0 mol/L C.2.0 mol/L D.1.0 mol/L 組卷:154引用:52難度:0.7
二、非選擇題(共6小題,52分)
-
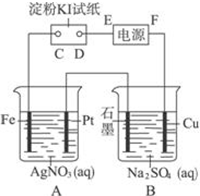 21.室溫下,用下圖所示的裝置進行電解.通電一會兒,發現濕潤的淀粉KI試紙的C端變為藍色.若電解結束時,A、B裝置中共收集到氣體1.68L(標準狀況),假設電解過程中無其他副反應發生,經測定電解后A中溶液體積恰為1000mL,求此時A溶液的pH值.(提示:pH=-lgc(H+))組卷:256引用:2難度:0.5
21.室溫下,用下圖所示的裝置進行電解.通電一會兒,發現濕潤的淀粉KI試紙的C端變為藍色.若電解結束時,A、B裝置中共收集到氣體1.68L(標準狀況),假設電解過程中無其他副反應發生,經測定電解后A中溶液體積恰為1000mL,求此時A溶液的pH值.(提示:pH=-lgc(H+))組卷:256引用:2難度:0.5 -
22.10.6g某有機化合物A完全燃燒后,得到0.8molCO2氣體和9.0g H2O,該有機化合物對氫氣的相對密度是53.
(1)求該有機物的相對分子質量;
(2)求該有機物的分子式;
(3)根據下列實驗現象及結論,寫出該有機物的結構簡式.
①分子中含有苯環,
②它能使KMnO4酸性溶液褪色,
③它能發生硝化反應,當引入1個硝基時,只能得到1種硝基化合物.組卷:8引用:3難度:0.1


