2021-2022學年廣東省佛山一中高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一、(每題2分,共44分)
-
1.化學與環境、材料、信息、能源關系密切,下列說法中不正確的是( )
A.“光化學煙霧”、“臭氧空洞”的形成都與氮氧化合物有關 B.高鐵酸鉀(K2FeO4)是一種新型高效、多功能水處理劑,既能殺菌消毒又能凈水 C.高純度的二氧化硅廣泛用于制作光導纖維,光導纖維遇強堿會“斷路” D.盡量使用含12C的產品,減少使用含13C或14C的產品符合“促進低碳經濟”宗旨 組卷:5引用:5難度:0.8 -
2.SO2可用作紅酒的防腐劑。下列關于SO2的敘述不正確的是( )
A.無色無味氣體 B.能與氫氧化鈉溶液反應 C.能使品紅溶液褪色 D.一定條件下,能與氧氣反應 組卷:35引用:3難度:0.6 -
3.Cl2和SO2都具有漂白作用,能使品紅溶液褪色.若將等物質的量的Cl2、SO2混合后,再通入品紅與BaCl2的混合溶液,能觀察到的現象是( )
①溶液很快褪色②溶液不褪色③出現沉淀④不出現沉淀.A.①② B.①③ C.②③ D.②④ 組卷:383引用:12難度:0.9 -
4.下列物質中按其成分能與玻璃、水泥、陶瓷歸于一類的是( )
A.硅 B.碳化硅 C.硅酸鈉 D.二氧化硅 組卷:24引用:1難度:0.8 -
5.現有下列5個轉化,其中不可能通過一步反應實現的是( )
①SiO2→Na2SiO3 ②Si→SiO2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→NaOHA.①② B.③④ C.②③④ D.②③④⑤ 組卷:4引用:1難度:0.7 -
6.現欲分離氯化鈉和氯化銨的混合物,可采用的方法是( )
A.加入NaOH溶液 B.加入AgNO3溶液 C.加熱并冷卻 D.加入水 組卷:11引用:6難度:0.7 -
7.用NA表示阿伏加德羅常數的值。下列敘述正確的是( )
A.標準狀況下,80gSO3的體積為22.4L B.標準狀況下,2.24LCl2與過量稀NaOH溶液反應,轉移的電子總數為0.2NA C.已知反應:2NH3+NO+NO2═2N2+3H2O,每生成28gN2轉移的電子數目為3NA D.58.5gNaCl中含有NA個NaCl分子 組卷:9引用:4難度:0.8 -
8.宏觀辨識與微觀探析是化學學科核心素養之一。下列物質性質對應的離子方程式書寫錯誤的是( )
A.向硫酸氫鈉溶液中滴加氫氧化鋇溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O B.向CaCl2溶液中通入足量CO2:Ca2++H2O+CO2═2H++CaCO3↓ C.用食醋清洗水垢(CaCO3)的原理:2CH3COOH+CaCO3═CO2↑+Ca2++2CH3COO-+H2O D.實驗室若用磨砂玻璃塞蓋在了盛放NaOH溶液的試劑瓶上:SiO2+2OH-═SiO32-+H2O 組卷:67引用:3難度:0.6
二、第二部分非選擇題(56分)
-
25.甲、乙兩同學為探究SO2與可溶性鋇的強酸鹽能否反應生成白色BaSO3沉淀,用如圖所示裝置進行實驗(夾持裝置和A中加熱裝置已略,氣密性已檢驗)

實驗操作和現象:
(1)A中反應的化學方程式是操作 現象 關閉彈簧夾,滴加一定量濃硫酸(其濃度很高),加熱 A中有白霧生成,銅片表面產生氣泡
B中有氣泡冒出,產生大量白色沉淀
C中產生白色沉淀,液面上方略顯淺棕色并逐漸消失打開彈簧夾,通入N2,停止加熱,一段時間后關閉 從B、C中分別取少量白色沉淀,加稀鹽酸 尚未發現白色沉淀溶解 。
(2)C中白色沉淀是(填化學式,下同),C中液面上方生成的淺棕色氣體是。
(3)分析B中不溶于稀鹽酸的沉淀產生的原因,甲認為是空氣參與反應,乙認為是白霧參與反應。
①為證實各自的觀點,在原實驗基礎上:甲在原有操作之前增加一步操作,該操作是;乙在A、B間增加洗氣瓶D,D中盛放的試劑是。
②進行實驗,B中現象:
檢驗白色沉淀,發現均不溶于稀鹽酸,請寫出乙中產生少量白色沉淀的離子方程式:甲 大量白色沉淀 乙 少量白色沉淀 。
(4)合并(3)中兩同學的方案進行試驗。B中無沉淀生成,而C中產生白色沉淀,根據甲、乙同學的實驗目的可得出的結論是。組卷:21引用:3難度:0.4 -
26.氮氧化物(NO、NO2)、SO2是大氣污染物。回答下列問題:
(1)以上污染物會造成的環境問題有(寫一種即可)。
(2)如圖包含氣體發生裝置和收集裝置(部分裝置的夾持儀器已省略),實驗室以Cu與濃HNO3反應制備并收集NO2,應選擇的裝置是(填字母)。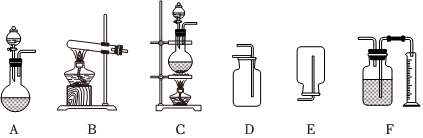
(3)SCR脫硝技術已成為使用廣泛和成熟的煙氣凈化技術,脫硝效率高達90%以上。反應機理如圖所示,寫出該反應發生的化學方程式:。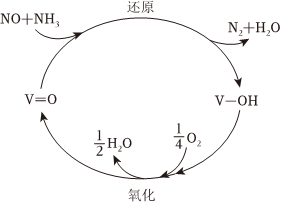
(4)目前,NaClO溶液廣泛地應用于脫硫脫硝。某課外小組同學設計了如圖噴淋吸收塔裝置(如圖)。設計該裝置的優點是,脫硝(NO)反應的離子方程式為。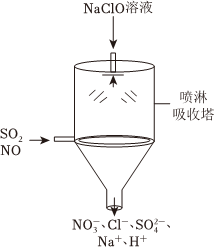
(5)某興趣小組用Fe2(SO4)溶液吸收含SO2的尾氣(SO2的體積分數約10%,其余為空氣),實驗裝置如圖所示: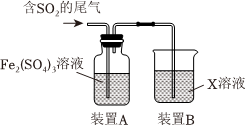
①裝置B中X溶液為。
②反應后,若要檢驗SO2是否過量,可用試劑為。
③若實驗測得反應后的裝置A中不含有SO2,為測定其中所含FeSO4的物質的量濃度,現進行如下實驗:取20.00mL裝置A中溶液,向其中逐滴加入0.1000mol?L-1Ce(SO4)2溶液,發生反應Fe2++Ce4+=Ce3++Fe3+,當反應恰好完全時,共消耗Ce(SO4)2溶液18.00mL。請通過計算確定FeSO4的物質的量濃度。組卷:26引用:1難度:0.6


