2020-2021學年廣東省清遠一中實驗學校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(每題只有一個選項符合題意。每題3分共30分)
-
1.下列說法正確的是( )
A.1molH2與0.5molO2反應放出的熱就是H2的燃燒熱 B.已知2CO2(g)=2CO(g)+O2(g)△H=+566kJ/mol 則CO的燃燒熱△H=-283.0kJ/mol C.H2SO4與Ba(OH)2反應生成1molH2O時放出的熱叫做中和熱 D.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1,則任何酸堿中和的反應熱均為57.3kJ 組卷:410引用:2難度:0.6 -
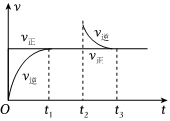 2.恒溫密閉容器中發生可逆反應:Z(?)+W(?)?X(g)+Y(?)△H,在t1時刻反應達到平衡,在t2時刻縮小容器容積,t3時刻再次達到平衡狀態后不再改變條件。下列有關說法中正確的是( )
2.恒溫密閉容器中發生可逆反應:Z(?)+W(?)?X(g)+Y(?)△H,在t1時刻反應達到平衡,在t2時刻縮小容器容積,t3時刻再次達到平衡狀態后不再改變條件。下列有關說法中正確的是( )A.Z和W在該條件下有一種可能為氣態 B.t1~t2時間段與t3時刻后,兩時間段內反應體系中氣體的平均摩爾質量不可能相等 C.若該反應的△H>0,則該反應的平衡常數K隨溫度升高而增大 D.若在該溫度下此反應的平衡常數表達式為K=c(X),則t1~t2時間段與t3時刻后的X濃度不相等 組卷:27引用:3難度:0.6 -
3.體積完全相同的兩個容器A和B,已知A裝有SO2和O2各1g,B只裝有SO2和O2各2g,在相同溫度下兩個容器中發生反應:2SO2(g)+O2(g)?2SO3(g),達到平衡時A中SO2的轉化率為a%,B中SO2的轉化率為b%,則A、B兩容器中SO2轉化率的關系正確的是( )
A.a%>b% B.a%=b% C.2a%=b% D.a%<b% 組卷:5引用:1難度:0.5 -
4.已知CH4(g)和CO(g)的燃燒熱分別是890.3kJ?mol-1和 283.0kJ?mol-1,則由CH4(g)不完全燃燒生成1mol CO(g)和H2O(l)的△H為( )
A.-607.3 kJ?mol-1 B.+607.3 kJ?mol-1 C.-324.3 kJ?mol-1 D.+324.3 kJ?mol-1 組卷:18引用:3難度:0.5 -
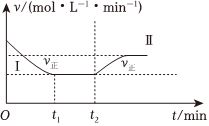 5.在某一恒溫恒容的密閉容器中發生如下反應:3H2(g)+N2(g)?2NH3(g)ΔH<0.t1時刻到達平衡后,在t2時刻改變某一條件,其反應過程如圖所示.下列說法正確的是( )
5.在某一恒溫恒容的密閉容器中發生如下反應:3H2(g)+N2(g)?2NH3(g)ΔH<0.t1時刻到達平衡后,在t2時刻改變某一條件,其反應過程如圖所示.下列說法正確的是( )A.Ⅰ、Ⅱ兩過程達到平衡時,平衡常數:KⅠ<KⅡ B.Ⅰ、Ⅱ兩過程達到平衡時,NH3的體積分數:Ⅰ<Ⅱ C.Ⅰ、Ⅱ兩過程達到平衡的標志:氣體密度不再發生變化 D.t2時刻改變的條件可以是向密閉容器中加H2和N2混合氣 組卷:114引用:6難度:0.7 -
6.在水溶液中,CrO42-呈黃色,Cr2O72-呈橙紅色,重鉻酸鉀(K2Cr2O7)在水溶液中存在以下平衡:Cr2O72-+H2O?2H++2CrO42-,下列說法正確的是( )
A.向該溶液中加入過量濃NaOH溶液后,溶液呈橙紅色 B.該反應是氧化還原反應 C.向該溶液中滴加適量的濃硫酸,平衡向逆反應方向移動,再次達到平衡后,氫離子濃度比原溶液大 D.向體系中加入少量水,平衡逆向移動 組卷:112引用:11難度:0.5
三、填空題(共50分)
-
19.(1)某濃度的氨水中存在平衡:NH3?H2O?NH4++OH-。若要增大NH4+的濃度而不增大OH-的濃度,應采取的措施是
(填字母)。
a.適當升高溫度
b.加入NH4Cl固體
c.通入NH3
d.加入少量濃鹽酸
(2)常溫下,有c(H+)相同、體積相同的醋酸和鹽酸兩種溶液。
①加適量醋酸鈉晶體后,醋酸溶液中c(H+)(填“增大”、“減小”或“不變”,下同),鹽酸中c(H+)。
②加水稀釋10倍后,溶液中c(H+):醋酸(填“>”、“=”或“<”)鹽酸。
③加等濃度的NaOH溶液至恰好中和,所需NaOH溶液的體積:醋酸(“>”、“=”或“<”)鹽酸。
④溶液溫度都升高20℃,溶液中c(H+):醋酸(填“>”、“=”或“<”)鹽酸。
⑤分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是(填字母)。(①表示鹽酸,②表示醋酸)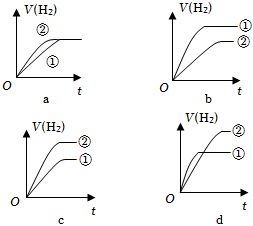
(3)將0.1mol?L-1的CH3COOH加水稀釋,有關稀釋后醋酸溶液的說法正確的是(填字母)。
a.電離程度增大
b.溶液中離子總數增多
c.溶液導電性增強
d.溶液中醋酸分子增多組卷:44引用:3難度:0.5 -
20.下表是幾種弱酸常溫下的電離平衡常數:
(1)CH3COOH、H2CO3、H2S、H3PO4四種酸的酸性由強到弱的順序為CH3COOH H2CO3 H2S H3PO4 1.8×10-3 K1=4.3×10-7
K2=5.6×10-11K1=9.1×10-8
K2=1.1×10-12K1=7.5×10-3
K2=6.2×10-6
K3=2.2×10-13。
(2)同濃度的CH3COO-、HCO3-、CO32-、S2-結合H+的能力由強到弱的順序為。
(3)寫出下列反應的離子方程式:向Na2S溶液中通入少量的CO2氣體。組卷:54引用:1難度:0.7


