2020-2021學年湖南省常德市臨澧一中高二(下)段考化學試卷(二)
發(fā)布:2024/12/27 17:0:4
一、選擇題(本題包括16小題,每小題3分,共48分。每小題只有一個選項符合題意)
-
1.下列說法中正確的是( )
A.在化學反應過程中,發(fā)生物質變化的同時不一定發(fā)生能量變化 B.生成物全部化學鍵形成時所釋放的能量大于破壞反應物全部化學鍵所吸收的能量時,反應為吸熱反應 C.生成物的總能量大于反應物的總能量時,反應吸熱,△H>0 D.△H的大小與熱化學方程式的計量系數(shù)無關 組卷:59引用:27難度:0.9 -
2.下列敘述正確的是( )
A.其它條件相同時,增大反應物濃度使分子獲得能量,活化分子百分數(shù)提高,反應速率增大 B.體系有自發(fā)地向混亂度增加(即熵增)的方向轉變的傾向,這是自然界的普遍規(guī)律 C.判斷過程的自發(fā)性能確定過程能否發(fā)生和過程發(fā)生的速率 D.催化劑不影響反應活化能,從而只影響反應速率,不影響化學平衡 組卷:12引用:1難度:0.7 -
3.某學生的實驗報告所列出的下列數(shù)據(jù)中合理的是( )
A.用25mL酸式滴定管量取13.17mL稀鹽酸 B.用10mL量筒量取7.13mL稀鹽酸 C.用廣泛pH試紙測得某溶液的pH為2.3 D.用托盤天平稱取物品的質量為5.872g 組卷:7引用:1難度:0.6 -
4.下列事實不能用勒夏特列原理解釋的是( )
A.溴水中有下列平衡Br2+H2O?HBr+HBrO,當加入硝酸銀溶液后,溶液顏色變淺 B.開啟啤酒后,瓶中馬上泛起大量泡沫 C.鋼鐵在潮濕的空氣中容易生銹 D.實驗室中常用排飽和食鹽水的方法收集氯氣 組卷:30引用:1難度:0.7 -
5.S(單斜)和S(正交)是硫的兩種同素異形體.
已知:①S(單斜,s)+O2(g)═SO2(g)△H1=-297.16kJ?mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ?mol-1
③S(單斜,s)═S(正交,s)△H3
下列說法正確的是( )A.△H3=+0.33 kJ?mol-1 B.單斜硫轉化為正交硫的反應是吸熱反應 C.S(單斜,s)═S(正交,s)△H3<0,正交硫比單斜硫穩(wěn)定 D.S(單斜,s)═S(正交,s)△H3>0,單斜硫比正交硫穩(wěn)定 組卷:71引用:41難度:0.7 -
6.SF6是一種優(yōu)良的絕緣氣體,分子結構中只存在S-F鍵.已知:1molS(s)轉化為氣態(tài)硫原子吸收能量280kJ,斷裂1molF-F、S-F鍵需吸收的能量分別為160kJ、330kJ.則S(s)+3F2(g)=SF6(g)的反應熱△H為( )
A.-1780 kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol 組卷:81引用:6難度:0.7 -
7.室溫時,某溶液中由水電離生成的H+和OH-物質的量濃度的乘積為1×10-24,則在該溶液中一定不能大量共存的離子組是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、CO32- C.NH4+、Na+、Cl-、SO42- D.NH4+、K+、SiO32-、NO3- 組卷:38引用:7難度:0.7
二、填空題(每空2分,共52分)
-
20.已知一定溫度和壓強下,在容積為VL的密閉容器中充入1molA和1molB,保持恒溫恒壓下反應:A(g)+B(g)?C(g)△H<0。達到平衡時,C的體積分數(shù)為40%。試回答有關問題:
(1)在相同溫度下,若保持容器體積VL不變,起始充入1molA和1molB,達到平衡時,C的體積分數(shù)40%(填“>”、“<”或“=”)。
(2)若平衡時,保持容器容積不變,使容器內壓強增大,則平衡。
A.一定向正反應方向移動
B.一定向逆反應方向移動
C.一定不移動
D.不一定移動
(3)若使溫度、壓強在上述條件下恒定不變,在密閉容器中充入2molA和2molB,則反應達到平衡時,C的體積分數(shù)為;容器的容積為。組卷:16引用:1難度:0.4 -
21.(1)真空碳熱冶鋁法包含很多反應,其中的三個反應如下:
Al2O3(s)+3C(s)═Al2OC(s)+2CO(g)△H1
2Al2OC(s)+3C(s)═Al4C3(s)+2CO(g)△H2
2Al2O3(s)+9C(s)═Al4C3(s)+6CO(g)△H3
則△H3=(用△H1、△H2表示)。
(2)下列是碳熱還原法制錳合金的三個反應,CO與CO2平衡分壓比的自然對數(shù)值(lnK=2.303lgK)與溫度的關系如圖所示(已知Kp是用平衡分壓代替濃度計算所得的平衡常數(shù),分壓=總壓×氣體的物質的量分數(shù))。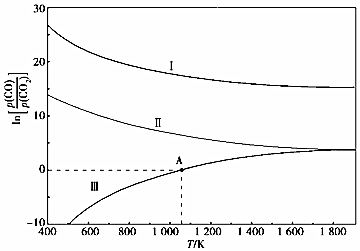
Ⅰ.Mn3C(s)+4CO2(g)?3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g)?MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g)?3Mn(s)+2CO(g) Kp(Ⅲ)
①△H>0的反應是(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1200K時,在一體積為2L的恒容密閉容器中有17.7gMn3C(s)和0.4molCO2,只發(fā)生反應Ⅰ,5min后達到平衡,此時CO的濃度為0.125mol/L,則0~5min內v(CO2)=。
③在一體積可變的密閉容器中加入一定量的Mn(s)并充入一定量的CO2(g),只發(fā)生反應Ⅱ,下列能說明反應Ⅱ達到平衡的是(填字母)。
A.容器的體積不再改變
B.固體的質量不再改變
C.氣體的總質量不再改變
④向恒容密閉容器中加入Mn3C并充入0.1molCO2,若只發(fā)生反應Ⅲ,則在A點反應達到平衡,當容器的總壓為akPa時,CO2的轉化率為;A點對應溫度下Kp(Ⅲ)=。組卷:7引用:1難度:0.5


