2023-2024學年湖北省武漢市硚口區高三(上)起點質檢化學試卷
發布:2024/9/20 4:0:8
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列變化或應用中,與氧化還原反應無關的是( )
A.飽和(NH4)2SO4溶液中加入少量雞蛋清變渾濁 B.油酸甘油酯通過氫化反應變為硬脂酸甘油酯 C.切開土豆、蘋果,在空氣中放置一段時間后變色 D.食用補鐵劑(含琥珀酸亞鐵)時常與維生素C同服 組卷:20引用:2難度:0.7 -
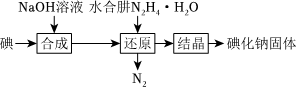 2.采用水合肼(N2H4?H2O)還原法制取碘化鈉固體,其制備流程如圖所示,已知:“合成”步驟中生成的副產物為。IO-3
2.采用水合肼(N2H4?H2O)還原法制取碘化鈉固體,其制備流程如圖所示,已知:“合成”步驟中生成的副產物為。IO-3
下列說法中不正確的是( )A.“合成”過程所得溶液中主要含有I-、IO-、 和Na+IO-3B.“還原”過程消耗10g的離子方程式為2 +3N2H4?H2O═3N2↑+2I-+9H2OIO-3C.“水合肼還原法”的優點是N2H4?H2O被氧化后的產物為N2和H2O,不引入雜質 D.工業上常用鐵屑還原NaIO3制備NaI,理論上該反應中氧化劑與還原劑的物質的量之比為1:2 組卷:11引用:2難度:0.6 -
3.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.1molNH4F晶體中含有共價鍵數目為3NA B.100g質量分數為17%的H2O2溶液中sp3雜化的原子數約為5.6NA C.標準狀況下,11.2LNO和11.2LO2混合后的分子數目為NA D.0.1molKClO3與足量濃鹽酸反應生成氯氣,轉移電子數為0.6NA 組卷:11引用:1難度:0.7 -
4.關于化合物
 ,下列說法正確的是( )
,下列說法正確的是( )A.分子中至少有7個碳原子共直線 B.分子中含有1個手性碳原子 C.與酸或堿溶液反應都可生成鹽 D.不能使酸性KMnO4稀溶液褪色 組卷:877引用:12難度:0.6 -
5.化學用語可以表達化學過程,下列化學用語的表達錯誤的是( )
A.中子數為12的鈉原子: 2311NaB.NaCl電子式: 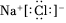
C.用電子云輪廓圖表示H-H的s-sσ鍵形成的示意圖: 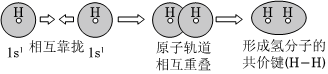
D.用化學方程式表示尿素與甲醛制備線型脲醛樹脂:  組卷:14引用:1難度:0.5
組卷:14引用:1難度:0.5 -
6.某多孔儲氫材料前驅體結構如圖,M、W、X、Y、Z五種元素原子序數依次增大,基態Z原子的電子填充了3個能級,其中有2個未成對電子。下列說法正確的是( )

A.氫化物沸點:X>Y B.原子半徑:M<X<Y<Z C.第一電離能:W<X<Y<Z D.陰、陽離子中均有配位鍵 組卷:783引用:13難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.鍶與氮氣在加熱條件下可生成氮化鍶(Sr3N2),氮化鍶遇水劇烈反應。已知:醋酸二氨合亞銅溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;連苯三酚堿性溶液能定量吸收O2。實驗室設計如下裝置制備氮化鍶(各裝置盛裝足量試劑),所使用的氮氣樣品可能含有少量CO、CO2、O2等氣體雜質。回答下列問題:
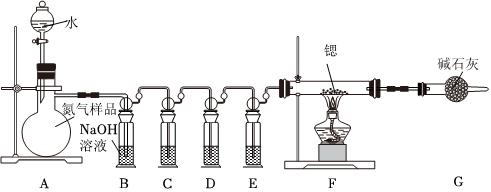
Ⅰ.氮化鍶的制取
(1)裝置A中裝有水的儀器的名稱是。
(2)裝置C中盛裝的試劑是(填標號,下同),裝置D中盛裝的試劑是。
a.連苯三酚堿性溶液
b.醋酸二氨合亞銅溶液
(3)裝置G的作用是。
Ⅱ.產品純度的測定
稱取7.7gⅠ中所得產品,加入干燥的三頸燒瓶中,然后由恒壓漏斗加入蒸餾水,通入水蒸氣,將產生的氨全部蒸出,用200mL 1.00mol?L-1鹽酸標準溶液完全吸收(吸收液體積變化忽略不計)。從燒杯中量取20.00mL吸收液,用1.00mol?L-1NaOH標準溶液滴定過剩的HCl,到終點時消耗NaOH標準溶液15.00mL。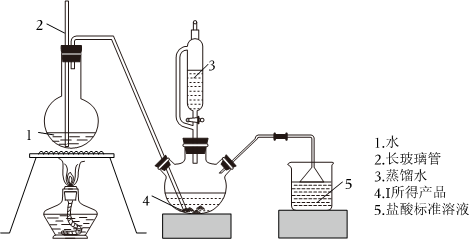
(4)三頸燒瓶中發生反應產生氣體的化學方程式為。
(5)產品純度為%(保留整數)。組卷:6引用:3難度:0.5 -
19.我國力爭于2030年前實現碳達峰,2060年前實現碳中和。CO2催化加氫合成二甲醚是一種實現“碳中和”理想的CO2轉化方法。該過程中涉及的反應:
主反應:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)ΔH
副反應:CO2(g)+H2(g))?CO(g)+H2O(g)ΔH′=+41.2kJ?mol-1
回答下列問題:
(1)主反應通過以下步驟來實現:
Ⅰ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1=-49.5kJ?mol-1
Ⅱ.2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ?mol-1
則主反應的ΔH=kJ?mol-1。
(2)在恒壓、CO2和H2的起始量一定時,CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖所示,CH3OCH3的選擇性=×100%。2×CH3OCH3的物質的量反應的CO2的物質的量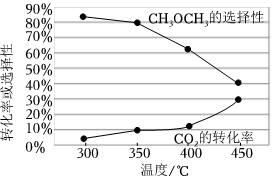
①CO2平衡轉化率隨溫度升高而增大的原因是。
②420℃時,在催化劑作用下CO2與H2反應一段時間后,測得CH3OCH3的選擇性約為50%。不改變反應時間,一定能提高CH3OCH3選擇性的措施有(填標號)。
A.升高溫度
B.增大壓強
C.增大c(CO2)
D.更換適宜的催化劑
(3)在溫度為543K。原料組成為n(CO2):n(H2)=1:3、初始總壓為4MPa恒容密閉容器中進行反應,體系達到平衡時CO2的轉化率為30%,二甲醚的選擇性為50%,則氫氣的轉化率α(H2)=;主反應的壓強平衡常數Kp=(列出計算式)。
(4)二甲醚直接燃料電池具有啟動快、效率高、能量密度大等優點。若電解質溶液呈堿性,二甲醚直接燃料電池的負極反應為。
(5)1,2-丙二醇(CH2OHCHOHCH3)單分子解離反應相對能量如圖所示,路徑包括碳碳鍵斷裂解離和脫水過程。從能量的角度分析,TS1、TS2、TS3、TS4四種路徑中路徑的速率最慢。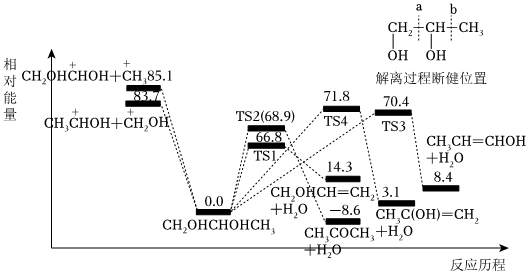 組卷:24引用:1難度:0.5
組卷:24引用:1難度:0.5


