2017年天津市高考化學模擬試卷
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.下列防疫物品的主要成分不屬于有機物的是( )
A. 
聚丙烯B. 
聚碳酸酯C. 
二氧化氯D. 
丁腈橡膠組卷:56引用:4難度:0.8 -
2.下列表述不正確的是( )
A.CO2的電子式: 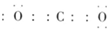
B.CCl4的比例模型: 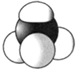
C.丙烯的鍵線式: 
D.基態原子Te的價層電子排布圖: 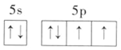 組卷:6引用:1難度:0.6
組卷:6引用:1難度:0.6 -
3.下列敘述正確的是( )
A.電負性:Si<Cl<P B.還原性:HF>HCl>HBr C.第一電離能:Al>Mg>Na D.熔點:SiO2>NaCl>H2O>H2S 組卷:10引用:1難度:0.7 -
4.我國科學家研制出一種催化劑,能在室溫下高效催化空氣中甲醛的氧化,其反應如下:HCHO+O2
CO2+H2O。下列有關說法正確的是( )催化劑A.HCHO分子中C的雜化類型為sp3雜化 B.CO2分子中的化學鍵為非極性鍵 C.HCHO分子中σ鍵與π鍵數目比為3:1 D.每生成1.8gH2O消耗2.24LO2 組卷:12引用:1難度:0.6 -
5.下列有關水處理方法不正確的是( )
A.用石灰、碳酸鈉等堿性物質處理廢水中的酸 B.用可溶性的鋁鹽和鐵鹽處理水中的懸浮物 C.用氯氣處理水中的Cu2+、Hg2+等重金屬離子 D.用燒堿處理含高濃度 的廢水并回收利用氨NH+4組卷:1136引用:22難度:0.9
二、解答題(共4小題,滿分64分)
-
15.用沉淀滴定法快速測定NaI等碘化物溶液中c(I-),實驗過程包括準備標準溶液和滴定待測溶液。
Ⅰ.準備標準溶液
a.準確稱取AgNO3基準物4.2468g(0.0250mol)后,配制成250mL標準溶液,放在棕色試劑瓶中避光保存,備用。
b.配制并標定100mL 0.1000mol?L-1 NH4SCN標準溶液,備用。
Ⅱ.滴定的主要步驟
a.取待測NaI溶液25.00mL于錐形瓶中。
b.加入25.00mL 0.1000mol?L-1 AgNO3溶液(過量),使I-完全轉化為AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示劑。
d.用0.1000mol?L-1NH4SCN溶液滴定過量的Ag+,使其恰好完全轉化為AgSCN沉淀后,體系出現淡紅色,停止滴定。
e.重復上述操作兩次。三次測定數據如下表:
f.數據處理。實驗序號 1 2 3 消耗NH4SCN標準溶液體積/mL 20.24 20.02 19.98
回答下列問題:
(1)將稱得的AgNO3配制成標準溶液,所使用的儀器除燒杯和玻璃棒外還有。
(2)AgNO3標準溶液放在棕色試劑瓶中避光保存的原因是。
(3)滴定應在pH<0.5的條件下進行,其原因是。
(4)b和c兩步操作是否可以顛倒,說明理由。
(5)所消耗的NH4SCN標準溶液平均體積為mL,測得c(I-)=mol?L-1。
(6)在滴定管中裝入NH4SCN標準溶液的前一步,應進行的操作為。
(7)判斷下列操作對c(I-)測定結果的影響(填“偏高”、“偏低”或“無影響”)
①若在配制AgNO3標準溶液時,燒杯中的溶液有少量濺出,則測定結果。
②若在滴定終點讀取滴定管刻度時,俯視標準液液面,則測定結果。組卷:41引用:7難度:0.6 -
16.H2S和SO2會對環境和人體健康帶來極大的危害,工業上采取多種方法減少這些有害氣體的排放,回答下列方法中的問題。
Ⅰ.H2S的除去
方法1:生物脫H2S的原理為:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO42Fe2(SO4)3+2H2O硫桿菌
(1)硫桿菌存在時,FeSO4被氧化的速率是無菌時的5×105倍,該菌的作用是。
(2)由圖1和圖2判斷使用硫桿菌的最佳條件為。若反應溫度過高,反應速率下降,其原因是。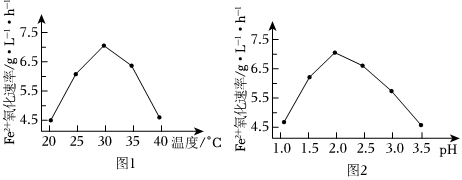
方法2:在一定條件下,用H2O2氧化H2S
(3)隨著參加反應的n(H2O2)/n(H2S)變化,氧化產物不同。當n(H2O2)/n(H2S)=4時,氧化產物的分子式為。
Ⅱ.SO2的除去
方法1(雙堿法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液Na2SO3溶液①SO2②CaO
(4)寫出過程①的離子方程式:;CaO在水中存在如下轉化:
CaO(s)+H2O (l)═Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)
從平衡移動的角度,簡述過程②NaOH再生的原理。
方法2:用氨水除去SO2
(5)已知25℃,NH3?H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的濃度為2.0mol?L-1,溶液中的c(OH-)=mol?L-1.將SO2通入該氨水中,當c(OH-)降至1.0×10-7 mol?L-1時,溶液中的c()/c(SO2-3)=HSO-3。組卷:1193引用:13難度:0.5


