2020-2021學年吉林省遼源五中高一(下)第一次月考化學試卷
發布:2024/11/27 13:0:2
一、單項選擇(此題共26小題,每題2分,共52分)
-
1.下列化合物能由兩種單質直接化合生成的是( )
A.FeCl2 B.NO2 C.CuS D.SO2 組卷:8引用:3難度:0.5 -
2.下列化學用語書寫正確的是( )
A.氮氣的電子式: 
B.硫原子的結構示意圖: 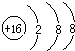
C.溴化鈉的電子式: 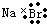
D.水分子的結構式:H-O-H 組卷:31引用:8難度:0.9 -
3.下列物質的轉化在給定條件下能實現的是( )
①SO2Na2SO3NaOH溶液Na2SO4H2SO4(aq)
②FeFe2O3O2點燃Fe2(SO4)3H2SO4(aq)
③AlAl2O3O2點燃NaAlO2NH3?H2O
④N2NOO2點燃NO2O2HNO3H2OA.① B.①② C.③④ D.全部 組卷:11引用:1難度:0.6 -
4.在探究SO2水溶液成分和性質的實驗中,下列根據實驗現象得出的結論正確的是( )
A.向Na2CO3固體中滴加少量SO2水溶液,沒有氣泡產生,說明SO2水溶液的酸性比碳酸弱 B.向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀產生,說明SO2水溶液中含有SO42- C.向SO2水溶液中通入H2S氣體,有淡黃色沉淀產生,說明SO2具有氧化性 D.向KMnO4溶液中滴加SO2水溶液,溶液顏色褪去,說明SO2具有漂白性 組卷:109引用:3難度:0.5 -
5.下列有關化學反應的敘述中正確的是( )
A.過二硫酸鈉Na2S2O8具有較強氧化性,原因是硫元素具有高價態+7價 B.光照氯氣和氫氣的混合物生產鹽酸 C.氫硫酸(H2S的水溶液)只具有還原性 D.SO2與過量氨水反應生成(NH4)2SO3 組卷:8引用:1難度:0.6 -
6.N、O、S是重要的非金屬元素,下列說法正確的是( )
A.N、O、S、的原子半徑逐漸增大,非金屬性逐漸減弱 B.氮的氧化物和硫的氧化物既是形成光化學煙霧的主要物質,又是形成酸雨的主要物質 C.汽車尾氣中排放的氮氧化物主要是由游離態氮轉化來的 D.由于NH3分子間存在氫鍵,所以其穩定性強于H2S 組卷:10引用:1難度:0.8 -
7.下列的說法正確的是( )
A.0.1molFe在0.1molCl2中充分燃燒,轉移電子數為0.2NA B.12mol/L的濃硫酸50mL與足量的Cu加熱反應,得到SO2為0.3NA C.3molNO2與足量的水反應轉移的電子數為NA D.1mol/LNa2SO4溶液中,陰、陽離子總數為3NA 組卷:8引用:3難度:0.6 -
8.根據下列實驗操作和現象所得到的結論正確的是( )
選項 實驗操作和現象 結論 A 將一塊用砂紙打磨過的鋁條放入試管,再加入98.3%濃硫酸3mL,鋁條表面無明顯現象 鋁與濃硫酸常溫下不反應 B 向盛有某鹽溶液的試管中滴入氫氧化鈉溶液后,試管口處濕潤的紅色石蕊試紙未變藍 該鹽中不含NH4+ C 室溫下,向FeCl3溶液中滴加少量KI溶液,再滴加幾滴淀粉溶液,溶液變藍色 Fe3+的氧化性比I2的強 D 將濃鹽酸加入到濃硫酸中,用來實驗室快速制HCl氣體 該實驗體現了高沸點酸制取低沸點酸的原理 A.A B.B C.C D.D 組卷:7引用:1難度:0.5 -
9.有一瓶無色氣體,可能含有HCl、H2S、CO2、HBr、SO2中的一種或幾種,將其通入氯水中得無色透明溶液,把溶液分成兩份,向一份中加入鹽酸酸化的BaCl2溶液,出現白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀,以下結論正確的是( )
①原氣體中肯定有SO2,②原氣體中可能有SO2,③原氣體中肯定沒有H2S、HBr,④不能肯定原氣體中是否含有HCl,⑤原氣體中肯定無CO2,⑥原氣體中肯定有HCl.A.①③④ B.②④ C.①③⑥ D.①③⑤⑥ 組卷:50引用:14難度:0.5 -
10.工業上制汞的過程是:焙燒辰砂(主要含HgS),發生反應:HgS+O2
Hg+SO2,還原出的汞呈氣態,冷凝得液態汞。其流程如圖,下列說法不正確的是( )△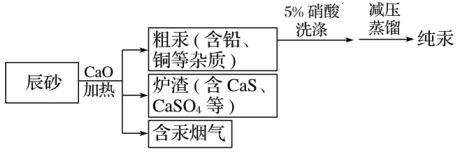
A.含汞煙氣可以采用活性炭吸附法處理達標后再排放 B.HgS+O2 Hg+SO2該反應中HgS不只作還原劑△C.洗滌粗汞時不可用5%的硫酸代替5%的硝酸 D.流程中加入氧化鈣產生的爐渣主要成分是CaSO3 組卷:5引用:1難度:0.4
四、流程題
-
30.NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等,其一種生產工藝如圖:

已知電解總反應為:2ClO2+2NaCl2NaClO2+Cl2。回答下列問題:電解
(1)NaClO2中Cl的化合價為。
(2)工業上常用黃鐵礦(FeS2)為原料制備硫酸,配平下面方程式:FeS2+O2高溫Fe2O3+SO2。
(3)從物質分類角度來看,NaHSO4是(填字母)。
a.酸
b.酸式鹽
c.電解質
d.非電解質
e.離子化合物
f.共價化合物
(4)寫出“反應”步驟中生成ClO2的化學方程式。
(5)“電解”所用食鹽水由粗鹽水精制而成,精制時,為除去Mg2+和Ca2+,要加入的試劑分別為、。
(6)“尾氣吸收”是吸收“電解”過程排出的少量ClO2。此吸收反應中,氧化劑(ClO2)與還原劑(H2O2)的物質的量之比為。組卷:34引用:6難度:0.5 -
31.已部分氧化的亞硫酸鈉,為確定其純度,要進行如下實驗:①稱取樣品W1g;②將樣品溶于蒸餾水中;③給溶液加稍過量的經鹽酸酸化的BaCl2溶液;④過濾、洗滌、干燥沉淀,稱其質量為W2g,試回答:
(1)檢查SO42-是否沉淀完全的實驗方法:。
(2)判斷沉淀是否洗凈的實驗方法:。
(3)Na2SO3純度的表示式:。(用W1、W2表示)組卷:29引用:2難度:0.5


