2022-2023學(xué)年江西省吉安一中高一(上)期末化學(xué)試卷
發(fā)布:2024/7/15 8:0:9
一.單選題(每小題0分,共30分)
-
1.中國(guó)傳統(tǒng)文化對(duì)人類(lèi)文明貢獻(xiàn)巨大,下列關(guān)于古代化學(xué)的應(yīng)用和記載,對(duì)其說(shuō)明不合理的是( )
A.我國(guó)古代四大發(fā)明之一的黑火藥是由硫磺粉、硝酸鉀和木炭粉按照一定比例混合而成,爆炸時(shí)發(fā)生氧化還原反應(yīng) B.《天工開(kāi)物》中記載了火法煉鋅的工藝,冶煉過(guò)程中鋅元素被還原 C.西漢時(shí)期的(淮南萬(wàn)畢術(shù))中有“曾青得鐵,則化為銅”的記載,所涉及的化學(xué)反應(yīng)為:Fe+CuSO4=FeSO4+Cu D.《論衡》中有“司南之杓,投之于地,其柢指南”,“杓”所用的材質(zhì)為FeO 組卷:18引用:3難度:0.7 -
2.下列各項(xiàng)說(shuō)法正確的是( )
A.“84”消毒液的有效成分是NaClO B.SO2具有漂白性,可用于加工食品,使食品增白 C.可以用酒精萃取碘水中碘單質(zhì) D.SO2氣體通入Ba(NO3)2溶液中不能產(chǎn)生白色沉淀 組卷:62引用:2難度:0.7 -
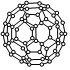 3.設(shè)NA代表阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )
3.設(shè)NA代表阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )A.標(biāo)準(zhǔn)狀況下,22.4LCCl4中所含的原子數(shù)為5NA B.28gN60(分子結(jié)構(gòu)如圖所示)中含有的N-N數(shù)目為1.5NA C.0℃1.01×105Pa時(shí),11.2L氧氣中所含的原子數(shù)為NA D.常溫下,將5.6g鐵投入足量的稀硫酸中,充分反應(yīng),轉(zhuǎn)移電子數(shù)為0.3NA 組卷:43引用:1難度:0.8 -
4.亞氨基鋰(Li2NH)是一種儲(chǔ)氫容量高、安全性好的固體儲(chǔ)氫材料,其儲(chǔ)氫原理可表示為L(zhǎng)i2NH+H2═LiNH2+LiH.下列有關(guān)說(shuō)法錯(cuò)誤的是( )
A.Li2NH中N的化合價(jià)是-3 B.1molH2參與反應(yīng),還原產(chǎn)物比氧化產(chǎn)物多15g C.該反應(yīng)中H2既是氧化劑又是還原劑 D.1molH2參與反應(yīng)時(shí)有1mol電子發(fā)生轉(zhuǎn)移 組卷:72引用:3難度:0.7 -
5.下列說(shuō)法正確的是 ( )
A.硫酸、純堿、醋酸鈉和生石灰分別屬于酸、堿、鹽和氧化物 B.溶液與膠體:本質(zhì)區(qū)別是能否發(fā)生丁達(dá)爾效應(yīng) C.常溫下可以用鋁或鐵制容器貯存濃硝酸和濃硫酸 D.用焰色反應(yīng)鑒別NaCl溶液和Na2SO4溶液 組卷:75引用:2難度:0.9 -
6.下列說(shuō)法正確的是( )
A.Fe2+、Mg2+、Cl-、 能大量共存于pH=0的溶液中NO-3B.1 L濃度為l mol?L-1的NH4Cl溶液中含有NA個(gè) NH+4C.除去NO中混有的少量NO2,可將混合氣體通過(guò)盛有水的洗氣瓶,再用排空氣法收集NO D.反應(yīng)MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共轉(zhuǎn)移0.8mol電子 組卷:26引用:5難度:0.7
三、填空題(除標(biāo)注外每空1分,共50分)
-
19.Ⅰ.金屬的冶煉和處理常涉及氧化還原反應(yīng)。
(1)由下列物質(zhì)冶煉相應(yīng)金屬時(shí)采用熱還原法的是(填標(biāo)號(hào))。
A.Fe2O3
B.NaCl
C.HgO
D.Al2O3
Ⅱ.工業(yè)上由黃銅礦(主要成分為CuFeS2,其中Cu、Fe均為+2價(jià))冶煉銅的主要流程如圖: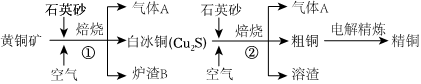
(2)火法煉銅的主要反應(yīng)有:
步驟①:2CuFeS2+4O2Cu2S+3SO2+2FeO(爐渣);800℃
步驟②:2Cu2S+3O22Cu2O+2SO2。1200℃
步驟①的反應(yīng)中轉(zhuǎn)移1.8mol電子時(shí),被還原的O2分子數(shù)為NA;步驟②中發(fā)生兩步反應(yīng),銅產(chǎn)物(Cu2S、Cu2O)在1200℃條件下發(fā)生反應(yīng)生成單質(zhì)銅,請(qǐng)寫(xiě)出相應(yīng)的化學(xué)方程式:。
(3)由1molCuFeS2生成1molCu,理論上共消耗molO2。
(4)氣體A中的大氣污染物可選用(填標(biāo)號(hào))吸收。
a.濃H2SO4
b.稀HNO3
c.NaOH溶液
(5)爐渣B的主要成分是FeO、Al2O3、SiO2,為了得到鐵紅,加入鹽酸溶解后,過(guò)濾,濾清的主要成分為(填化學(xué)式),對(duì)濾液進(jìn)行處理最終得到鐵紅的過(guò)程中不可能涉及的步驟是(填標(biāo)號(hào))。
①氧化
②還原
③灼燒
④加堿組卷:6引用:4難度:0.6 -
20.四氧化三鐵納米微粒可用于涂料、油墨、隱身材料、磁記錄、電極材料、催化劑等多領(lǐng)域,實(shí)驗(yàn)室可用如下的方法來(lái)制備這種材料并進(jìn)行檢測(cè)。
Ⅰ.制備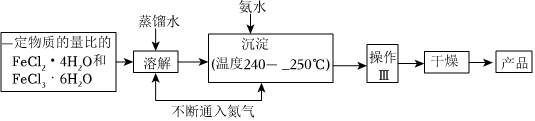
(1)溶解、沉淀操作中不斷通入氮?dú)庥袃蓚€(gè)作用:①是通過(guò)在反應(yīng)過(guò)程中通入氣體形成微型氣泡,將剛生成的四氧化三鐵微粒包圍,來(lái)阻止微粒的長(zhǎng)大或聚集成團(tuán);②。
(2)操作Ⅲ的名稱(chēng)是。
Ⅱ.產(chǎn)品檢測(cè)
(一)定性檢測(cè):產(chǎn)品中鐵元素價(jià)態(tài)檢測(cè)
試劑主要有:3mol/L硫酸、0.1mol/L氫氧化鈉溶液、20%硫氰化鉀溶液、0.01mol/L酸性高錳酸鉀溶液、氯水(其它用品任選)
(3)請(qǐng)選用上述試劑完成下表
(二)定量測(cè)定:步驟 操作 現(xiàn)象、結(jié)論 1 取一定量3mol/L硫酸溶液于試管中,加熱煮沸去除溶解氯氣 - 2 取少量產(chǎn)品于試管中加適量步驟1處理好溶液溶解,配成溶液 固體溶解,溶液呈淺黃色 3 取少量步驟2配好溶液于試管中,滴加幾滴20%硫氰化鉀溶液,振蕩 ,產(chǎn)品含有Fe3+4 ,產(chǎn)品含有Fe2+
稱(chēng)取23.2g樣品于燒杯中,加入加熱煮沸后的稀硫酸充分溶解,并不斷加熱、攪拌,待固體完全溶解后,向所得溶液中加入10.0g銅粉充分反應(yīng)后過(guò)濾、洗滌、干燥得剩余固體3.6g。取濾液體積的用濃度為0.200mol?L-1的酸性KMnO4滴定,至終點(diǎn)時(shí)消耗KMnO4溶液體積29.80mL。110
(4)產(chǎn)品中Fe3+和Fe2+的物質(zhì)的量之比為。
Ⅲ.結(jié)果討論
(5)產(chǎn)品中Fe3+和Fe2+的物質(zhì)的量之比略大于2:1的可能原因是。組卷:3引用:1難度:0.5


