2023-2024學年北京市豐臺區(qū)高二(上)期中化學試卷(B卷)
發(fā)布:2024/10/2 16:0:1
一、選擇題(共42分)本部分共14小題,每小題3分,共42分。在每小題給出的四個選項中,選出最符合題意的一項。
-
1.下列裝置或過程能實現(xiàn)電能轉化為化學能的是( )

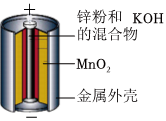

A.火力發(fā)電 B.堿性鋅錳電池 C.電池充電 D.氫氧燃料電池 A.A B.B C.C D.D 組卷:22引用:3難度:0.7 -
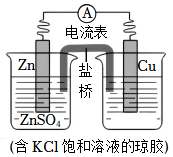 2.鋅銅原電池裝置如右圖,下列說法不正確的是( )
2.鋅銅原電池裝置如右圖,下列說法不正確的是( )A.鋅電極上發(fā)生氧化反應 B.鹽橋中的K+移向ZnSO4溶液 C.電子從鋅片經電流計流向銅片 D.銅電極上發(fā)生反應:Cu2++2e-═Cu 組卷:366引用:17難度:0.7 -
3.下列說法正確的是( )
A.放熱反應一定是自發(fā)反應 B.熵增的反應不一定是自發(fā)反應 C.固體溶解一定是熵減小的過程 D.非自發(fā)反應在任何條件下都不能發(fā)生 組卷:312引用:13難度:0.8 -
4.在一定條件下發(fā)生反應2A(g)═2B(g)+C(g),將2mol A通入2L容積恒定的密閉容器甲中,若維持容器內溫度不變,5min末測得A的物質的量為0.8mol.用B的濃度變化來表示該反應的速率為( )
A.0.24 mol/(L?min) B.0.08 mol/(L?min) C.0.06 mol/(L?min) D.0.12 mol/(L?min) 組卷:106引用:9難度:0.7 -
5.下列事實不能用化學平衡移動原理解釋的是( )
A.實驗室收集氯氣時,常用排飽和食鹽水的方法 B.用濃氨水和氫氧化鈉固體快速制取氨氣 C.工業(yè)合成氨N2(g)+3H2(g)?2NH3(g)ΔH<0,采用400℃~500℃的高溫條件 D.紅棕色NO2加壓后顏色先變深后變淺 組卷:12引用:1難度:0.6 -
6.下列示意圖與化學用語表述閃容不相符的是(水合離子用相應離子符號表示)( )
A B C D
NaCl溶于水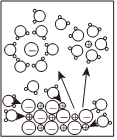
銅鋅原電池工作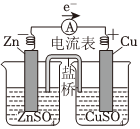
一種燃料電池工作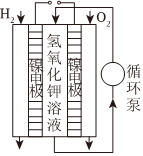
電解飽和食鹽水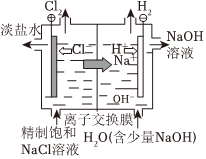
電離方程式:NaCl═Na++Cl- 總反應:Zn+Cu2+═Zn2++Cu 負極反應:H2-2e-+2OH-═2H2O 總反應:2Cl-+2H+ Cl2↑+H2↑通電A.A B.B C.C D.D 組卷:63引用:3難度:0.7
二、非選擇題(共58分)
-
18.合成氨是人類科學技術上的一項重大突破,氨有廣泛的應用。
(1)目前工業(yè)合成氨的主要方法是HaberBosch法,化學反應原理如下:N2(g)+3H2(g)2NH3(g)。450℃/Fe200bar
①該反應放熱,但仍選擇較高溫度,原因是。
②理論上,為了增大平衡時H2的轉化率,可采取的措施是(寫出1條)。
③將物質的量之比為1:3的N2和H2充入2L的密閉容器中,在一定條件下達到平衡,測得平衡時數(shù)據(jù)如下:
該條件下H2的轉化率為物質 N2 H2 NH3 平衡時物質的量/mol 0.2 0.6 0.2 ,平衡常數(shù)K=(可用分數(shù)表示)。
④若按以下濃度投料,其它反應條件與①相同,起始時反應進行的方向為(填“正向”、“逆向”或“無法判斷”)。
⑤L(L1、L2)、X可分別代表壓強或溫度。如圖表示L一定時,合成氨反應中H2(g)的平衡轉化率隨X的變化關系。物質 N2 H2 NH3 起始濃度(mol/L) 0.5 1.5 0.5 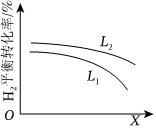
ⅰ.X代表的物理量是。
ⅱ.判斷L1、L2的大小關系,并簡述理由。
(2)電化學氣敏傳感器可用于檢測環(huán)境中NH3的含量,其工作原理如圖所示,則a極的電極反應式為。反應消耗的O2與NH3的物質的量之比為。 組卷:4引用:1難度:0.5
組卷:4引用:1難度:0.5 -
19.電化學原理在污染治理方面有著重要的作用。
Ⅰ.煤在直接燃燒前要進行脫硫處理。采用電解法脫硫的基本原理如圖所示,利用電極反應將Mn2+轉化為Mn3+,Mn3+再將煤中的含硫物質(主要成分是FeS2)氧化為Fe3+和:FeS2+15Mn3++8H2O=Fe3++15Mn2++2SO2-4+16H+。SO2-4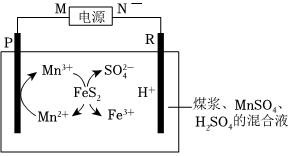
已知:兩電極為完全相同的惰性電極。
回答下列問題:
(1)M為電源的(填“正極”或“負極”)。
(2)電解池工作時,觀察到R電極上有無色氣體產生,寫出電極反應式。
(3)電解池工作時,混合液中的物質的量SO2-4(填“變大”、“變小”或“不變”)。
(4)電解過程中,混合溶液中的pH將(填“變大”、“變小”或“不變”),理由是。
Ⅱ.電解還原法處理酸性含鉻廢水:以鐵板做陰、陽極,電解含鉻廢水,示意如圖。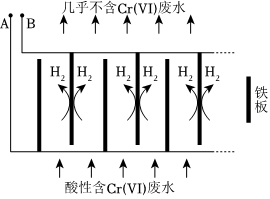
(1)電解開始時,A極上主要發(fā)生的電極反應式為。
(2)產生的Fe2+將Cr2還原為Cr3+的離子方程式為O2-7。
(3)隨著電解的進行,陽極鐵板會發(fā)生鈍化,表面形成FeO?Fe2O3的鈍化膜,使電解池不能正常工作。將陰極鐵板與陽極鐵板交換使用,一段時間后,鈍化膜消失。結合有關反應,解釋鈍化膜消失的原因:。Ⅲ.微生物電池可用來處理廢水中的對氯苯酚,原理如圖所示。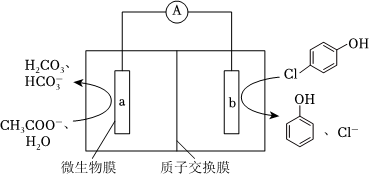
(1)該電池放電時,H+向(填“a”或“b”)極遷移。
(2)a極上生成H2CO3的電極反應為。
(3)已知b極的電極反應為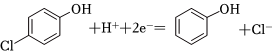 ,經處理后的水樣中要求對氯苯酚的含量小于mmol/L。若廢水中對氯苯酚的含量是nmol/L,則處理1m3廢水,至少添加CH3COO-的物質的量為 mol(溶液體積變化忽略不計)。組卷:29引用:1難度:0.7
,經處理后的水樣中要求對氯苯酚的含量小于mmol/L。若廢水中對氯苯酚的含量是nmol/L,則處理1m3廢水,至少添加CH3COO-的物質的量為 mol(溶液體積變化忽略不計)。組卷:29引用:1難度:0.7


