2022-2023學年福建省廈門市集美中學高三(上)期中化學試卷
發布:2024/9/13 0:0:8
一、選擇題(每題只有一個正確選項,16題,共48分)
-
1.生活中處處有化學,下列敘述正確的是( )
A.HB鉛筆芯的成分為二氧化鉛 B.碳酸氫鈉可做食品膨松劑 C.青銅和黃銅是不同結構的單質銅 D.焰火中紅色來源于鈉鹽灼燒 組卷:52引用:9難度:0.7 -
2.反應NH4Cl+NaNO2═NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是( )
A.中子數為18的氯原子: Cl1817B.N2的結構式:N═N C.Na+的結構示意圖: 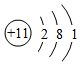
D.H2O的電子式: 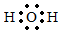 組卷:736引用:39難度:0.7
組卷:736引用:39難度:0.7 -
3.宋代《千里江山圖)描繪了山清水秀的美麗景色,歷經千年色彩依然,其中綠色來自孔雀石顏料[主要成分為Cu(OH)2?CuCO3],青色來自藍銅礦顏料[主要成分為Cu(OH)2?2CuCO3]。下列說法錯誤的是( )
A.保存《千里江山圖》需控制溫度和濕度 B.孔雀石、藍銅礦顏料不易被空氣氧化 C.孔雀石、藍銅礦顏料耐酸耐堿 D.Cu(OH)2?CuCO3中銅的質量分數高于Cu(OH)2?2CuCO3 組卷:823引用:29難度:0.6 -
 4.價類二維圖是學習元素及其化合物知識的重要模型。它是以元素化合價為縱坐標,以物質類別為橫坐標的二維平面圖象。如圖為氯元素的價類二維圖。下列敘述不正確的是( )
4.價類二維圖是學習元素及其化合物知識的重要模型。它是以元素化合價為縱坐標,以物質類別為橫坐標的二維平面圖象。如圖為氯元素的價類二維圖。下列敘述不正確的是( )A.上述6種物質,屬于電解質的有4種 B.將②與SO2按物質的量之比1:1通入水中,再滴加紫色石蕊試液,溶液變紅 C.可以用濃氨水檢查輸送②的管道是否漏氣,在此過程中②既作氧化劑又作還原劑 D.用H2C2O4、NaClO3和H2SO4三種物質制取③時,還會生成CO2等。生成1molCO2轉移電子的物質的量為1mol 組卷:54引用:3難度:0.6 -
5.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.0.1mol?L-1氨水溶液:Na+、K+、OH-、NO3- B.0.1mol?L-1鹽酸溶液:Na+、K+、SO42-、SiO32- C.0.1mol?L-1KMnO4溶液:NH4+、Na+、NO3-、I- D.0.1mol?L-1AgNO3溶液:NH4+、Mg2+、Cl-、SO42- 組卷:1414引用:20難度:0.5 -
6.雄黃(As4S4,
 )與雌黃(As2S3)在古代均曾入藥。二者可發生如圖轉化;NA表示阿伏加德羅常數的值,下列說法正確的是( )
)與雌黃(As2S3)在古代均曾入藥。二者可發生如圖轉化;NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.1mol雄黃分子中,含有S-S非極性共價鍵的數目為2NA B.反應Ⅰ每生成22.4LSO2氣體時,轉移的電子數目為7NA C.1mol雄黃分子中含有σ鍵的數目為10NA D.1L1mol/LNaH2AsO3溶液中,Na+、H2 、AsO-3數目之和為2NAAsO3-3組卷:18引用:4難度:0.7
二、非選擇題(4題,共52分)
-
19.稀土(RE)包括鑭、釔等元素,是高科技發展的關鍵支撐。我國南方特有的稀土礦可用離子交換法處理,一種從該類礦(含鐵、鋁等元素)中提取稀土的工藝如圖:

已知:月桂酸(C11H23COOH)熔點為44℃;月桂酸和(C11H23COO)3RE均難溶于水。該工藝條件下,稀土離子保持+3價不變;(C11H23COO)2Mg的Ksp=1.8×10-8;Al(OH)3開始溶解時的pH為8.8;有關金屬離子沉淀的相關pH見下表。
(1)“氧化調pH”中,化合價有變化的金屬離子是離子 Mg2+ Fe3+ Al3+ RE3+ 開始沉淀時的pH 8.8 1.5 3.6 6.2~7.4 沉淀完全時的pH / 3.2 4.7 / 。
(2)“過濾1”前,用NaOH溶液調pH至的范圍內,該過程中Al3+發生反應的離子方程式為。
(3)“過濾2”后,濾餅中檢測不到Mg元素,濾液2中Mg2+濃度為2.7g?L-1。為盡可能多地提取RE3+,可提高月桂酸鈉的加入量,但應確保“過濾2”前的溶液中c(C11H23COO-)低于mol?L-1(保留兩位有效數字)。
(4)①“加熱攪拌”有利于加快RE3+溶出、提高產率,其原因是。
②“操作X”的過程為:先,再固液分離。
(5)該工藝中,可再生循環利用的物質有(寫化學式)。
(6)稀土元素釔(Y)可用于制備高活性的合金類催化劑Pt3Y。
①還原YCl3和PtCl4熔融鹽制備Pt3Y時,生成1molPt3Y轉移mol電子。
②Pt3Y/C用作氫氧燃料電池電極材料時,能在堿性溶液中高效催化O2的還原,發生的電極反應為。組卷:683引用:4難度:0.3 -
20.金屬鈦(Ti)在航空航天、醫療器械等工業領域有著重要用途。目前生產鈦的方法之一是將金紅石(TiO2)轉化為TiCl4,再進一步還原得到鈦。回答下列問題:
(1)TiO2轉化為TiCl4有直接氯化法和碳氯化法。在1000℃時反應的熱化學方程式及其平衡常數如下:
(ⅰ)直接氯化:TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)ΔH1=172kJ?mol-1,Kp1=1.0×10-2
(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g)ΔH2=-51kJ?mol-1,Kp2=1.2×1012Pa
①反應2C(s)+O2(g)═2CO(g)的ΔH為kJ?mol-1,Kp=Pa。
②碳氯化的反應趨勢遠大于直接氯化,其原因是。
③對于碳氯化反應:增大壓強,平衡移動(填“向左”“向右”或“不”);溫度升高,平衡轉化率(填“變大”“變小”或“不變”)。
(2)在1.0×105Pa,將TiO2、C、Cl2以物質的量比1:2.2:2進行反應。體系中氣體平衡組成比例(物質的量分數)隨溫度變化的理論計算結果如圖所示。
①反應C(s)+CO2(g)═2CO(g)的平衡常數Kp(1400℃)=Pa。
②圖中顯示,在200℃平衡時TiO2幾乎完全轉化為TiCl4,但實際生產中反應溫度卻遠高于此溫度,其原因是。
(3)TiO2碳氯化是一個“氣-固-固”反應,有利于TiO2-C“固-固”接觸的措施是。組卷:970引用:3難度:0.5


