2020-2021學年黑龍江省哈爾濱六中高一(下)期末化學試卷
發(fā)布:2024/11/18 21:30:2
一、單項選擇題(本題包括25小題,每空2分,共計50分。每小題只有1個選項是正確的。)
-
1.中華優(yōu)秀傳統(tǒng)文化博大精深、源遠流長,王翰《涼州詞》中寫道“葡萄美酒夜光杯,欲飲琵琶馬上催…”。夜光杯的主要成分為3MgO?4SiO2?H2O,古代制作琵琶的主要原料為木料或竹料、絲線等,下列說法錯誤的是( )
A.由蠶絲搓紡而成的絲線的主要成分為蛋白質 B.忽略水和酒精之外的其它成分,葡萄美酒的度數越低,則酒的密度越低 C.夜光杯屬硅酸鹽產品,不溶于水,具有耐酸堿侵蝕、抗氧化等優(yōu)點 D.制作琵琶的竹料放入飽和Na2SiO3溶液中充分浸透后瀝干可起到防火的作用 組卷:144引用:6難度:0.8 -
2.下列說法不正確的是( )
A.高純硅可用于制作光感電池 B.SiO2因熔點高硬度大,可用于制光導纖維 C.石英砂可用于生產單晶硅 D.HF與SiO2反應的實際應用之一是氫氟酸在玻璃器皿上刻蝕標記 組卷:15引用:1難度:0.8 -
3.下列說法正確的是( )
A.明礬可用于自來水的殺菌消毒 B.漂白粉、活性炭、Na2O2都能使紅墨水褪色,其原理相同 C.濃硝酸在光照下顏色變黃,說明濃硝酸見光易分解 D.由反應 SiO2+4HF═SiF4↑+2H2O,可知SiO2是堿性氧化物 組卷:31引用:3難度:0.8 -
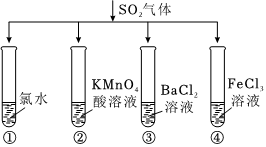 4.將SO2氣體分別通入下列四種溶液中,有關現象及結論的說法正確的是( )
4.將SO2氣體分別通入下列四種溶液中,有關現象及結論的說法正確的是( )A.試管①中有淡黃色沉淀生成,說明SO2有氧化性 B.試管②中溶液褪色,說明SO2有漂白性 C.試管③中能產生白色沉淀,說明SO2有酸性 D.試管④中溶液顏色變淺,說明SO2有還原性 組卷:905引用:6難度:0.7 -
5.某烴經催化加氫后,不能得到2-甲基丁烷,該烴是( )
A.2-甲基-1-丁烯 B.2-甲基-2-丁烯 C.3-甲基-1-丁炔 D.3,3-二甲基-1-丁炔 組卷:106引用:8難度:0.7 -
6.提取海帶中I2的實驗中,所選擇的裝置或儀器(夾持裝置已略去)正確的是( )
A. 
灼燒B. 
溶解C. 
過濾D. 
分液組卷:90引用:3難度:0.8 -
7.海水資源開發(fā)利用的部分過程如圖所示。下列說法正確的是( )

A.向鹽鹵中通入的氧化劑可能是SO2 B.工業(yè)生產中常選用NaOH作為沉淀劑 C.粗鹽可采用除雜和重結晶等過程提純 D.常用電解氫氧化鎂的方法制備金屬Mg 組卷:45引用:2難度:0.5 -
8.下列有關實驗操作和現象、結論都正確的是( )
操作和現象 結論 A 過量的Fe粉中加入稀HNO3,充分反應后,滴入KSCN溶液,溶液呈紅色 稀HNO3將Fe氧化為Fe3+ B 向淀粉溶液中加入稀H2SO4,加熱幾分鐘,冷卻后再加入新制Cu(OH)2濁液,加熱,沒有紅色沉淀生成。 淀粉沒有水解成葡萄糖 C 向無水乙醇加入濃H2SO4,加熱至170℃產生的氣體通入酸性KMnO4溶液,紅色褪去。 使溶液褪色的氣體是乙烯 D 用玻璃棒蘸取濃氨水點到紅色石蕊試紙上,試紙變藍色 濃氨水呈堿性 A.A B.B C.C D.D 組卷:5引用:1難度:0.7 -
9.若2 mol Mg跟5 mol HNO3恰好完全反應,則在該反應中的稀硝酸被還原成為( )
A.NO2 B.NO C.N2O D.N2 組卷:4引用:1難度:0.6 -
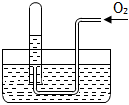 10.如圖所示,試管中盛裝的是紅棕色氣體(可能是混合物),當倒扣在盛有水的水槽中時,試管內液面上升,但不能充滿試管,當向試管內鼓入氧氣后,可以觀察到試管中液面繼續(xù)上升經過多次重復后,試管內完全被充滿,原來試管中盛裝的氣體是( )
10.如圖所示,試管中盛裝的是紅棕色氣體(可能是混合物),當倒扣在盛有水的水槽中時,試管內液面上升,但不能充滿試管,當向試管內鼓入氧氣后,可以觀察到試管中液面繼續(xù)上升經過多次重復后,試管內完全被充滿,原來試管中盛裝的氣體是( )A.可能是N2和NO2的混合氣體 B.可能是NO2一種氣體 C.一定是NO與NO2的混合氣體 D.一定是NO2氣體 組卷:26引用:2難度:0.7
二、非選擇題。
-
29.某探究小組用HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。所用HNO3濃度為1.00mol/L、2.00mol/L,大理石有細顆粒和粗顆粒兩種規(guī)格,實驗溫度為25℃、35℃,每次實驗HNO3的用量為25.00mL,大理石用量為10.00g。
(1)請完成以下實驗設計表,并在實驗目的一欄中填空:
(2)實驗①中CO2質量隨時間變化的關系如圖。計算實驗①中70s~90s范圍內用HNO3表示的平均反應速率實驗編號 溫度(℃) 大理石規(guī)格 HNO3濃度(mol/L) 實驗目的 ① 25 粗顆粒 2.00 (Ⅰ)實驗①和②探究濃度對反應速率的影響;
(Ⅱ)實驗①和③探究溫度對反應速率的影響;
(Ⅲ)實驗①和④探究對反應速率的影響② 25 粗顆粒
③
粗顆粒 2.00 ④
細顆粒
(忽略溶液體積變化,不需要寫出計算過程)。在0~70、70~90、90~200各不相同的時間段里,反應速率最大的時間段是。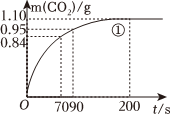 組卷:8引用:5難度:0.4
組卷:8引用:5難度:0.4 -
30.某小組利用H2C2O4溶液和硫酸酸化的KMnO4溶液反應來探究“外界條件對化學反應速率的影響”。實驗時通過測定酸性KMnO4溶液褪色所需時間 來判斷反應的快慢。該小組設計了如下方案。已知:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO2+10CO2↑+8H2O
(1)表中V1=
實驗 編號0.1mol/L酸性 KMnO4溶液的體積
/mL0.6mol/LH2C2O4
溶液的體積
/mLH2O的 體積
/mL
實驗溫度
/℃
溶液褪色所 需時間/min① 10 V1 35 25
t1② 10 10 30 25
t2③ 10 10 V2 50
t3mL,V2=mL。
(2)探究溫度對化學反應速率影響的實驗編號是(填編號,下同),可 探究反應物濃度對化學反應速率影響的實驗編號是。
(3)實驗①測得KMnO4溶液的褪色時間為2min,忽略混合前后溶液體積的微小變化,這段時間內平均反應速率v(H2C2O4)=mol?L-1?min-1。組卷:39引用:7難度:0.5


