2022-2023學年山東師大附中高二(上)期中化學試卷
發布:2024/11/11 20:30:2
一、單項選擇題(本題包括10小題,每小題2分,共20分)
-
 1.如圖中曲線表示一定條件下一定量的鋅粒與足量的稀硫酸反應的過程。若使曲線b變為曲線a,可采取的措施是( )
1.如圖中曲線表示一定條件下一定量的鋅粒與足量的稀硫酸反應的過程。若使曲線b變為曲線a,可采取的措施是( )A.加入少量的硫酸銅固體 B.加熱使溶液溫度升高 C.加入氯化鈉固體 D.加入碳酸鈉固體 組卷:22引用:1難度:0.7 -
2.T℃時,在2L剛性密閉容器中使X(g)與Y(g)發生反應生成Z(g)。反應過程中X、Y、Z的物質的量變化如圖1所示;若保持其他條件不變,溫度分別為T1和T2時,Y的體積百分含量與時間的關系如圖2所示。則下列結論錯誤的是( )

A.若改為恒溫恒壓條件,達平衡時Z的百分含量增大 B.保持其他條件不變,升高溫度,X的轉化率增大 C.反應進行的前3min內,用 X 表示的反應速率v(X)=0.2mol?L-1?min-1 D.若改變反應條件,使反應進程如圖3所示,則改變的條件是使用催化劑 組卷:16引用:1難度:0.5 -
3.將一定量純凈的NH4HS固體置于密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH4HS(s)?NH3(g)+H2S(g)。能判斷該反應已經達到化學平衡的是( )
①v(NH3)正=v(H2S)逆
②密閉容器中總壓強不變
③密閉容器中混合氣體的密度不變
④密閉容器中混合氣體的平均相對分子質量不變
⑤密閉容器混合氣體的總物質的量不變
⑥密閉容器中NH3的體積分數不變
⑦混合氣體總質量不變A.①②③④⑤⑦ B.①③⑤⑥ C.①②③⑤⑦ D.全部 組卷:72引用:1難度:0.5 -
 4.某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質,以CH4、CH3OH為燃料時,該電池工作原理如圖。下列說法正確的是( )
4.某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質,以CH4、CH3OH為燃料時,該電池工作原理如圖。下列說法正確的是( )A.a為CH4或CH3OH,b為CO2 B.正電極的電極反應式為O2+2CO2+4e-═2CO32- C.電池工作時,熔融碳酸鹽只起到導電的作用 D.CO32-向正極移動 組卷:75引用:1難度:0.9 -
5.鈷( Co )的合金材料廣泛應用于航空航天、機械制造等領域。如圖為水溶液中電解制備金屬鈷的裝置示意圖。下列說法正確的是( )

A.工作時,Ⅰ室和Ⅱ室溶液的 pH均增大 B.電解總反應:2Co2++2H2O 2Co+O2+4H+通電C.移除兩交換膜后,石墨電極上發生的反應不變 D.生成 2molCo,Ⅰ室溶液質量理論上減少32g 組卷:74引用:4難度:0.5 -
6.下列各組離子在指定溶液中一定能大量共存的是( )
A.c(HCO3-)=0.1mol?L-1的溶液中:Na+、K+、CO32-、Br- B.常溫下,由水電離產生的c(OH-)=1×10-12mol?L-1的溶液中:H+、Al3+、Cl-、NO3- C.無色透明的溶液中:K+、Mg2+、I-、MnO4- D.c(SO32-)=0.1mol?L-1的溶液K+、H+、SO42-、MnO4- 組卷:43引用:3難度:0.5
三、解答題(共5小題,滿分60分)
-
19.制印刷鋅板時,用稀硝酸腐蝕鋅板后得到的“廢液”(含有少量Cl-、Fe3+)稱為“爛板液”。某化學興趣小組用“爛板液”制取Zn(NO3)2?6H2O的過程如圖:

已知:Zn(OH)2能與強堿反應;常溫下,Ksp(Fe(OH)3=8×10-39,Ksp(Zn(OH)2=1.2×10-17。
(1)上述過程中多步操作需控制溶液pH,實驗室用pH試紙測溶液pH的正確操作是。
(2)操作1的名稱為,在操作1中pH不宜過高的原因是。
(3)操作2中加入的物質A可以是(填化學式),調節pH的范圍是。[已知:c(Zn2+)=0.12 mol?L-1,離子完全沉淀時濃度≤10-5mol?L-1,lg5=0.7]
(4)“冷卻結晶”步驟中需加入硝酸的目的是。組卷:11引用:1難度:0.4 -
20.乙二酸(H2C2O4)俗稱草酸,在實驗研究和化學工業中應用廣泛。
(1)25℃時,向10mL0.1mol?L-1H2C2O4溶液中逐滴加入0.1mol?L-1NaOH溶液,溶液中含碳微粒的物質的量分數隨溶液pH變化如圖所示: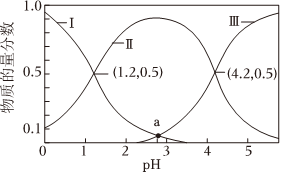
①等濃度的Na2C2O4和NaHC2O4混合溶液顯性。(填“酸”“堿”或“中”);25℃時,草酸的電離平衡常數分別是Ka1、Ka2,則=Ka1Ka2。
②a點溶液中,c(Na+)c(C2)+c(HC2O2-4)+c(H2C2O4)(填“>”“=”或“<”),此時溶液的pH=O-4。
(2)①酸性高錳酸鉀應該用(填“酸式”或“堿式”)滴定管盛裝。
②若要測定草酸亞鐵晶體(FeC2O4?xH2O)的x值,步驟如下:稱取0.5400g草酸亞鐵晶體溶于一定濃度的硫酸中,用KMnO4酸性溶液滴定,達到滴定終點時,消耗0.1000mol?L-1的酸性KMnO4溶液18.00mL。則x=。組卷:26引用:2難度:0.4


