2011-2012學年福建省三明市大田一中高二(上)寒假化學作業
發布:2024/4/20 14:35:0
一、解答題(共26小題,滿分0分)
-
1.(1)2H2(氣)+O2(氣)═2H2O(氣);△H=-484kJ/mol 2H2(氣)+O2(氣)═2H2O(液);△H=-572kJ/mol
若在標準狀況下,將H2和O2組成的混和氣體點燃燒爆炸后,再恢復到標準狀況,氣體體積減少33.6升,則反應放出的熱量是kJ.
(2)4克硫粉完全燃燒時放出37千焦熱量,該反應的熱化學方程式是.組卷:9引用:2難度:0.5 -
2.①CaCO3(s)═CaO+CO2(g);△H=177.7kJ/mol
②C(s)+H2O(g)═CO(g)+H2(g);△H=-131.3kJ/mol
③0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l);△H=-57.3kJ/mol
④C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
⑤CO(g)+1/2O2(s)═CO2(g);△H=-283kJ/mol
⑥HNO3 (aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l);△H=-517.6kJ/mol
(1)上述熱化學方程式中,不正確的有,不正確的理由分別是;
(2)根據上述信息,寫出C轉化為CO的熱化學方程式.組卷:12引用:1難度:0.9 -
3.右圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,電極均為石墨電極.
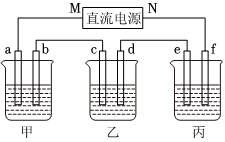
(1)接通電源,經過一段時間后,測得丙中K2SO4濃度為10.47%,乙中c電極質量增加.據此回答問題:
①電源的N端為極;
②電極b上發生的電極反應為;
③列式計算電極b上生成的氣體在標準狀況下的體積:
④電極c的質量變化是g;
⑤電解前后各溶液的酸、堿性大小是否發生變化,簡述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果電解過程中銅全部析出,此時電解能否繼續進行,為什么?.組卷:266引用:24難度:0.3 -
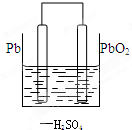 4.(1)鉛蓄電池在生產生活中有廣泛的應用,其工作原理為總方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中負極為;正極為;負極的電極反應式為:
4.(1)鉛蓄電池在生產生活中有廣泛的應用,其工作原理為總方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中負極為;正極為;負極的電極反應式為:
(2)飛船使用的氫氧燃料電池具有高能、輕便和不污染環境等優點.氫氧燃料電池有酸式和堿式兩種,其電池總反應均為:2H2+O2=2H2O.酸式氫氧燃料電池的電解質溶液是強酸溶液,其負極電極反應式可表示為:2H2-4e-=4H+,則其正極反應式為.組卷:30引用:1難度:0.9 -
5.已知可逆反應2NO(g)?N2(g)+O2(g).該反應的化學平衡常數表達式為
.
(1)若在某溫度下達到平衡時[N2]=0.5mol?L-1,[O2]=0.5mol?L-1,[NO]=0.1mol?L-1則平衡常數為;
(2)保持溫度不變,將容器體積縮小一半,則化學平衡常數為;
(3)而對于該反應,同溫度下,某時刻,若有c(N2)=0.1mol?L-1,C(O2)=0.1mol?L-1,c(NO)=0.2mol?L-1,是否為平衡狀態(填“是”或“否”)
(4)求該溫度下N2(g)+O2(g)?2NO(g)的化學平衡常數.組卷:21引用:1難度:0.9 -
6.現有反應:mA(g)+nB(g)?pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數也減小,則:
(1)該反應的逆反應為熱反應,且m+np(填“>”“=”“<”).
(2)減壓時,A的質量分數.(填“增大”“減小”或“不變”,下同)
(3)若加入B(體積不變),則A的轉化率.
(4)若升高溫度,則平衡時B、C的濃度之比將c(B)c(C).
(5)若加入催化劑,平衡時氣體混合物的總物質的量.組卷:75引用:14難度:0.5 -
7.可逆反應:aA(g)+bB(g)?cC(g)+dD(g);ΔH=Q試根據圖回答:
(1)壓強P1比P2(填大、小)
(2)體積(a+b)比(c+d)(填大、小)
(3)溫度t1℃比t2℃(填高、低)
(4)Q值是(填正、負) 組卷:53引用:6難度:0.3
組卷:53引用:6難度:0.3 -
8.反應CaCO3?CaO+CO2在不同溫度下,CO2的平衡壓強如下表:
根據上表數據,填寫下列空白:溫度/℃ 550 650 750 850 897 壓強/Pa 5.32×10 9.17×102 8.37×103 4.34×104 1.01×105
(1)若升高原CaCO3的分解平衡體系的溫度,同時給反應容器加壓,則原平衡.
A.向逆反應方向移動 B.向正反應方向移動
C.不移動 D.無法確定平衡移動方向
(2)在一個不與外界進行熱交換的密閉器中足量的CaCO3在850℃時建立分解平衡.若將該容器的容積擴大為原來的2倍,需重新達到平衡時,容器內的溫度將,CaCO3的分解率將,CO2的平衡壓強將4.34×104 Pa(填“>”、“=”、“<”),其理由是.組卷:7引用:2難度:0.5
一、解答題(共26小題,滿分0分)
-
25.將對H2相對密度為3.6 的N2與H2組成的混合氣0.5mol 通入一恒容密閉容器中,一定條件下發生反應,平衡時容器內壓強比反應前少了24%.求:
(1)反應前混合氣中N2和H2的質量比.
(2)平衡混合氣中,含氨的體積分數.
(3)平衡時N2、H2的轉化率.組卷:3引用:1難度:0.3 -
26.計算題將等體積的4×10-3mol/L的AgNO3溶液和4×10-3mol/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?[已知Ksp(Ag2CrO4)=9.0*10-12].
組卷:36引用:2難度:0.5


