2023年天津市十二區(qū)縣重點(diǎn)學(xué)校高考化學(xué)一模試卷
發(fā)布:2024/12/5 18:30:2
一、
-
1.近年來(lái),我國(guó)科技迅猛發(fā)展,下列科技成果中蘊(yùn)含的化學(xué)知識(shí)敘述錯(cuò)誤的是( )
A.建造港珠澳大橋所采用的高強(qiáng)抗震螺紋鋼屬于合金 B.DNA存儲(chǔ)技術(shù)中用于編碼的DNA是核糖核酸 C.華為麒麟芯片的主要成分是單質(zhì)硅 D.中國(guó)天眼FAST用到的SiC是新型無(wú)機(jī)非金屬材料 組卷:75引用:2難度:0.7 -
2.下列說(shuō)法正確的是( )
A.半徑:S2->K+ B.第一電離能:O>N C.沸點(diǎn):P2H4>N2H4 D.在CCl4中的溶解度:I2<NH3 組卷:127引用:2難度:0.7 -
3.下列關(guān)于各物質(zhì)的所屬類別及性質(zhì)的描述正確的是( )
選項(xiàng) A B C D 物質(zhì) NO2 NaCl 生鐵 氫氧化鐵膠體 類別 酸性氧化物 離子化合物 合金 電解質(zhì) 性質(zhì) 與水反應(yīng) 熔融態(tài)不導(dǎo)電 易發(fā)生電化學(xué)腐蝕 能產(chǎn)生丁達(dá)爾現(xiàn)象 A.A B.B C.C D.D 組卷:132引用:2難度:0.8 -
4.氯氣是一種重要的工業(yè)原料,工業(yè)上利用下列反應(yīng)來(lái)檢查氯氣管道是否漏氣:3Cl2+8NH3=N2+6NH4Cl。用NA表示阿伏加德羅常數(shù)的值,下列說(shuō)法錯(cuò)誤的是( )
A.NH4Cl中含有離子鍵、共價(jià)鍵 B.常溫常壓下,11.2LN2含有的分子數(shù)等于0.5NA C.N2的結(jié)構(gòu)式為N≡N,N2分子中含有σ鍵和π鍵 D.當(dāng)有1molCl2反應(yīng)時(shí)轉(zhuǎn)移電子的數(shù)目是2NA 組卷:85引用:2難度:0.7 -
5.對(duì)于可逆反應(yīng)2NO2(g)?N2O4(g),下列說(shuō)法錯(cuò)誤的是( )
A.當(dāng)2v(N2O4)正=v(NO2)逆時(shí),該反應(yīng)達(dá)到平衡狀態(tài) B.該反應(yīng)在一定條件下能自發(fā)進(jìn)行,則ΔH<0 C.恒溫恒容條件下,若混合氣體的顏色保持不變,則該反應(yīng)達(dá)到平衡狀態(tài) D.恒溫恒容條件下,達(dá)平衡狀態(tài)后,再充入一定量的NO2,NO2轉(zhuǎn)化率將減小 組卷:189引用:2難度:0.8
二、解答題(共4小題,滿分0分)
-
15.亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,在水中溶解度較大,遇酸放出ClO2,是一種高效的氧化劑和優(yōu)質(zhì)漂白劑,可用于各種纖維和某些食品的漂白,過(guò)氧化氫法制備NaClO2固體的實(shí)驗(yàn)裝置如圖所示:
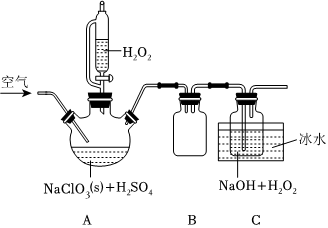
已知:
①ClO2的熔點(diǎn)為-59℃、沸點(diǎn)為11℃,極易溶于水,遇熱水、見(jiàn)光易分解:氣體濃度較大時(shí)易發(fā)生爆炸,若用空氣、CO2、氮?dú)獾葰怏w稀釋時(shí),爆炸性則降低。
②2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O。
請(qǐng)回答:
(1)A中盛放H2O2的儀器名稱為;按圖組裝好儀器后,首先應(yīng)該進(jìn)行的操作是。
(2)裝置B的作用是;C裝置使用冰水浴的目的。
(3)ClO2是合成NaClO2的重要原料,寫(xiě)出三頸燒瓶中由NaClO3生成ClO2的化學(xué)方程式:。
(4)裝置C中加入NaOH溶液的目的除了作反應(yīng)物外,還因?yàn)?。空氣的流速過(guò)慢或過(guò)快都會(huì)影響NaClO2的產(chǎn)率,試分析原因:。
(5)該套裝置存在的明顯缺陷是。
(6)若85.2gNaClO3(s)最終制得純凈的61.6gNaClO2(s),則NaClO2的產(chǎn)率是(保留兩位有效數(shù)字)。組卷:80引用:2難度:0.6 -
16.清潔能源的綜合利用以及二氧化碳的研發(fā)利用,可有效降低碳排放,均是實(shí)現(xiàn)“碳達(dá)峰、碳中和”的重要途徑,我國(guó)力爭(zhēng)于2030年前做到碳達(dá)峰,2060年前實(shí)現(xiàn)碳中和。
(1)利用反應(yīng):2CO2(g)+C2H6(g)?4CO(g)+3H2(g)可減少CO2的排放。
①CO2的結(jié)構(gòu)式為。C2H6分子中極性鍵與非極性鍵的個(gè)數(shù)比為。
②如圖是298K時(shí)相關(guān)物質(zhì)的相對(duì)能量,則上述反應(yīng)的ΔH=kJ/mol。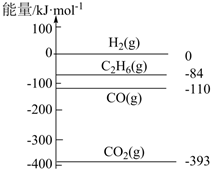
(2)利用反應(yīng):2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)ΔH<0可實(shí)現(xiàn)由CO2向C2H4的轉(zhuǎn)化。在恒壓密閉容器中,起始充入2mol CO2(g)和6mol H2(g)發(fā)生反應(yīng),該反應(yīng)在不同的溫度下達(dá)到平衡時(shí),各組分的體積分?jǐn)?shù)隨溫度的變化如圖所示。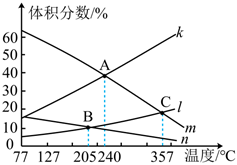
①圖中表示CO2的體積分?jǐn)?shù)隨溫度變化的曲線是(填字母)。(從曲線“k”、“l(fā)”、“m”或“n”中選擇)
②A、B、C三點(diǎn)對(duì)應(yīng)的化學(xué)平衡常數(shù)分別為KA、KB、KC,則三者從大到小的排列順序?yàn)?。
③C點(diǎn)反應(yīng)達(dá)到平衡后,CO2的平衡轉(zhuǎn)化率為(保留三位有效數(shù)字),若平衡時(shí)總壓為P,則平衡常數(shù)Kp=(列出計(jì)算式,以分壓表示,氣體分壓=總壓×氣體的物質(zhì)的量分?jǐn)?shù))。
(3)利用CO2可以合成HCOOH。25℃時(shí),pH=8的HCOONa溶液中,c(HCOOH)=。組卷:93引用:2難度:0.5


