魯科版(2019)選擇性必修1《2.2 化學反應的限度》2021年同步練習卷(6)
發布:2024/12/6 11:0:2
一、選擇題
-
1.如圖所示,三個大小相同的燒瓶中均充滿NO2氣體并分別放置在盛有下列物質的燒杯(燒杯內有等量的水)中:在燒杯(1)中加入適量CaO,燒杯(2)中不加其他物質,在燒杯(3)中加入適量NH4Cl晶體,發現燒瓶①中紅棕色加深,燒瓶③中紅棕色變淺。[已知反應2NO2(紅棕色)?N2O4(無色)]下列敘述正確的是( )

A.2NO2(g)?N2O4(g)是放熱反應 B.氯化銨晶體溶于水時放出熱量 C.燒瓶①中平衡時混合氣體的平均相對分子質量增大 D.燒瓶③中平衡時混合氣體的壓強增大 組卷:31引用:2難度:0.5 -
2.在一定溫度下的密閉容器中,加入1molCO和1molH2O發生反應CO(g)+H2O(g)?CO2(g)+H2(g),達到平衡時測得n(H2)=0.5mol,下列說法不正確的是( )
A.在該溫度下,反應的平衡常數K=1 B.平衡常數與反應溫度無關 C.CO的平衡轉化率為50% D.平衡時n(H2O)=0.5mol 組卷:44引用:4難度:0.4 -
3.對可逆反應2A(s)+3B(g)?C(g)+2D(g)△H<0,在一定條件下達到平衡,下列有關敘述正確的是( )
①增加A的量,平衡向正反應方向移動
②升高溫度,平衡向逆反應方向移動,v(正)減小
③壓強增大一倍,平衡不移動,v(正)、v(逆)不變
④增大B的濃度,v(正)>v(逆)
⑤加入催化劑,B的轉化率提高.A.①② B.④ C.③ D.④⑤ 組卷:476引用:89難度:0.9 -
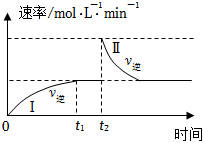 4.在某一恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)?2C(g)△H<0.t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程如圖。下列說法正確的是( )
4.在某一恒溫體積可變的密閉容器中發生如下反應:A(g)+B(g)?2C(g)△H<0.t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程如圖。下列說法正確的是( )A.0~t2時,v正>v逆 B.Ⅰ、Ⅱ兩過程達到平衡時,A的體積分數Ⅰ>Ⅱ C.t2時刻改變的條件可以是向密閉容器中加C D.Ⅰ、Ⅱ兩過程達到平衡時,平衡常數I>Ⅱ 組卷:101引用:7難度:0.6 -
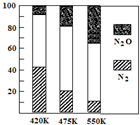 5.電廠煙氣脫氮的主反應為:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H1,
5.電廠煙氣脫氮的主反應為:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H1,
副反應為:2NH3(g)+8NO(g)?5N2O(g)+3H2O(g)△H2.平衡混合氣中N2與N2O含量與溫度的關系如右圖所示.下列說法不正確的是( )A.△H1<0,△H2>0 B.選擇合適的催化劑,升高溫度等措施可以加快脫氮反應速率 C.理論上較高的溫度和較低壓強有利于生成無公害氣體 D.反應過程中,采取不斷分離出N2(g) 有利于主反應的進行,提高反應物的轉化率 組卷:12引用:4難度:0.7 -
6.在一恒溫、恒容的密閉容器中發生反應A(s)+2B(g)?C(g)+D(g),當下列物理量不再變化時,不能夠表明該反應已達平衡狀態的是( )
A.混合氣體的壓強 B.混合氣體的平均相對分子質量 C.A的物質的量 D.B的物質的量濃度 組卷:122引用:4難度:0.7 -
7.在一體積可變的密閉容器中,加入一定量的X、Y,發生反應mX(g)?nY(g);△H=Q kJ/mol.反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如下表所示:
下列說法正確的是( )容器體積/L
c(Y)/(mol?L-1)
溫度/℃1 2 3 100 1.00 0.75 0.53 200 1.20 0.90 0.63 300 1.30 1.00 0.70 A.m>n B.Q<0 C.溫度不變,壓強增大,Y的質量分數減少 D.體積不變,溫度升高,平衡向逆反應方向移動 組卷:1235引用:62難度:0.7 -
8.某溫度下,在2L的密閉容器中,加入1molX(g)和2molY(g)發生反應:X(g)+mY(g)?3Z(g)。平衡時,X、Y、Z的體積分數分別為30%、60%、10%。在此平衡體系中加入1molZ(g),再次達到平衡后,X、Y、Z的體積分數不變。下列敘述不正確的是( )
A.m=2 B.兩次平衡的平衡常數相同 C.X與Y平衡轉化率之比為1:1 D.第二次平衡時,Z的濃度為0.4mol?L-1 組卷:513引用:34難度:0.5
三、原理綜合題
-
23.在1.0L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:A(g)?B(g)+C(g)△H=+85.1kJ?mol-1,反應時間(t)與容器內氣體總壓強(p)的數據見下表:
回答下列問題:時間t/h 0
1 2 4
816 20 25
30
總壓強p/100kPa4.91 5.58 6.32 7.31 8.54
9.509.52
9.539.53
(1)欲提高A的平衡轉化率,應采取的措施為.
(2)由總壓強p和起始壓強p0計算反應物A的轉化率α(A)的表達式為.平衡時A的轉化率為,列式并計算反應的平衡常數K.
(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),n總=mol,n(A)=mol.
②下表為反應物A濃度與反應時間的數據,計算a=;.
分析該反應中反應物的濃度c(A)變化與時間間隔(△t)的規律,得出的結論是
反應時間t/h0 4
8 16 c(A)/(mol?L-1) 0.10
a
0.026
0.0065
,由此規律推出反應在12h時反應物的濃度c(A)為mol?L-1.組卷:86引用:11難度:0.9
四、計算題
-
24.對于可逆反應CO+H2O(g)?CO2+H2,回答下列問題:
(1)830 K時,若起始時c(CO)=2 mol?L-1,c(H2O)=3 mol?L-1,平衡時CO的轉化率為60%,水蒸氣的轉化率為;平衡常數K的值為。
(2)830 K時,若只將起始時c(H2O)改為6 mol?L-1,則水蒸氣的轉化率為。
(3)若830 K時,某時刻混合體系中各氣體的濃度為c(CO2)=0.4 mol?L-1、c(CO)=0.6 mol?L-1、c(H2O)=3 mol?L-1,c(H2)=2 mol?L-1請判定該體系中反應進行的方向:(填“正向進行”“逆向進行”或“達到平衡”)。組卷:6引用:2難度:0.4


