2022-2023學(xué)年北京市牛欄山一中高二(上)期中化學(xué)試卷
發(fā)布:2024/12/15 0:0:2
一、選擇題(每題只有一個(gè)正確選項(xiàng),每小題2分,共42分)
-
1.下列反應(yīng)的能量變化與其它三個(gè)不相同的是( )
A.氫氣還原氧化銅 B.鈉與冷水的反應(yīng) C.碳酸鈣高溫分解 D.氯化銨與氫氧化鋇的反應(yīng) 組卷:23引用:1難度:0.7 -
2.下列溶液不一定呈酸性的是( )
A.c(OH-)<c(H+)的溶液 B.NaHSO4溶液 C.常溫下pH<7的溶液 D.與Al反應(yīng)產(chǎn)生氫氣的溶液 組卷:22引用:2難度:0.6 -
3.下列物質(zhì)中屬于弱電解質(zhì)的是( )
①CO2②CaCO3③H2SO4④冰醋酸⑤NaHCO3⑥氨水A.①②④⑥ B.②④ C.④ D.④⑥ 組卷:18引用:1難度:0.7 -
4.下列操作可以使水的離子積常數(shù)Kw增大的是( )
A.加熱 B.通入少量氯化氫氣體 C.通入少量氨氣 D.加入少量醋酸鈉固體 組卷:244引用:14難度:0.7 -
5.下列事實(shí)不能用勒夏特列原理解釋的是( )
A.100℃時(shí),純水的pH≈6 B.實(shí)驗(yàn)室用過氧化氫制取氧氣時(shí),常常加入MnO2固體 C.實(shí)驗(yàn)室常用排飽和食鹽水的方法收集氯氣 D.工業(yè)上采用高壓條件合成氨氣 組卷:13引用:2難度:0.7 -
6.物質(zhì)的量濃度相同的NaX、NaY和NaZ溶液,其pH依次為8、9、10,則HX、HY、HZ的酸性由強(qiáng)到弱的順序是( )
A.HX>HZ>HY B.HZ>HY>HX C.HX>HY>HZ D.HY>HZ>HX 組卷:24引用:1難度:0.7 -
7.一定量的1mol/L的鹽酸與足量鋅粉反應(yīng),當(dāng)向其中加入少量的下列物質(zhì)時(shí)能降低化學(xué)反應(yīng)速率,但不影響產(chǎn)生H2總量的是( )
①氯化鈉溶液
②醋酸鈉固體
③幾滴硫酸銅溶液
④0.1mol/L鹽酸
⑤NaOH溶液A.①② B.①④ C.④⑤ D.②③ 組卷:20引用:1難度:0.6 -
8.下列解釋事實(shí)的反應(yīng)方程式不正確的是( )
A.向碳酸鈉溶液中滴加酚酞溶液,溶液變紅:CO32-+2H2O?H2CO3+2OH- B.以Na2S為沉淀劑,除去溶液中的Cu2+:Cu2++S2-═CuS↓ C.向AgCl沉淀中滴加Na2S溶液,白色沉淀變成黑色:2AgCl+S2-?Ag2S+2Cl- D.向KI溶液中滴加稀硫酸和淀粉溶液,放置在空氣中溶液變藍(lán):4H++4I-+O2═2I2+2H2O 組卷:16引用:2難度:0.6 -
9.工廠的氨氮廢水可用電化學(xué)催化氧化法加以處理,其中NH3在電極表面的氧化過程的微觀示意圖如圖:

下列說法中,不正確的是( )A.過程①②均有N—H鍵斷裂 B.過程③的電極反應(yīng)式為:NH-e-+OH-═N+H2O C.過程④中有非極性鍵形成 D.催化劑可以降低該反應(yīng)的焓變 組卷:80引用:5難度:0.7
二、填空題(共58分)
-
26.純堿是重要的化工原料,在醫(yī)藥、冶金、化工、食品等領(lǐng)域被廣泛使用。
(1)工業(yè)生產(chǎn)純堿的第一步是除去飽和食鹽水的中Mg2+、Ca2+離子,從成本角度考慮加入試劑的化學(xué)式為、。某實(shí)驗(yàn)小組的同學(xué)模擬侯德榜制堿法制取純堿,流程如圖: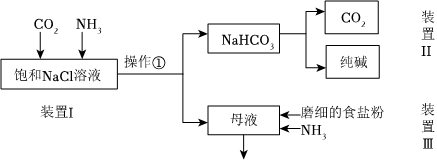
已知:幾種鹽的溶解度
(2)①寫出裝置Ⅰ中反應(yīng)的化學(xué)方程式NaCl NH4HCO3 NaHCO3 NH4Cl 溶解度(20℃,100gH2O時(shí)) 36.0 21.7 9.6 37.2 。
②從平衡移動(dòng)角度解釋該反應(yīng)發(fā)生的原因。
(3)寫出裝置Ⅱ中發(fā)生反應(yīng)的化學(xué)方程式。
(4)請(qǐng)結(jié)合化學(xué)用語(yǔ)說明裝置Ⅲ中加入磨細(xì)的食鹽粉及NH3的作用。
(5)該流程中可循環(huán)利用的物質(zhì)是。
(6)制出的純堿中含有雜質(zhì)NaCl,為測(cè)定其純度,下列方案中不可行的是。
a.向m克純堿樣品中加入足量CaCl2溶液,測(cè)生成CaCO3的質(zhì)量
b.向m克純堿樣品中加入足量稀H2SO4,干燥后測(cè)生成氣體的體積
c.向m克純堿樣品中加入足量AgNO3溶液,測(cè)生成沉淀的質(zhì)量組卷:10引用:1難度:0.7 -
27.學(xué)習(xí)小組探究AgNO3、Ag2O(棕黑色固體,難溶于水)對(duì)氯水漂白性的影響。實(shí)驗(yàn)記錄如下:
(1)用離子方程式表示i中品紅溶液褪色的原因:
實(shí)驗(yàn) 方案和現(xiàn)象 i 加入1mL蒸餾水,再滴加1滴品紅溶液,品紅溶液較快褪色 ii 加入少量Ag2O固體,產(chǎn)生白色沉淀a。再加入1mL蒸餾水和1滴品紅溶液,品紅溶液褪色比i快 iii 加入1mL較濃AgNO3溶液,產(chǎn)生白色沉淀b。再滴加1滴品紅溶液,品紅溶液褪色比i慢 。
(2)經(jīng)檢驗(yàn),ii中的白色沉淀a是AgCl。產(chǎn)生AgCl的化學(xué)方程式為。
(3)ⅰ是iii的對(duì)比實(shí)驗(yàn),目的是排除iii中造成的影響。
(4)研究白色沉淀b的成分。進(jìn)行實(shí)驗(yàn)iv(按實(shí)驗(yàn)iii的方案再次得到白色沉淀b,過濾、洗滌,置于試管中):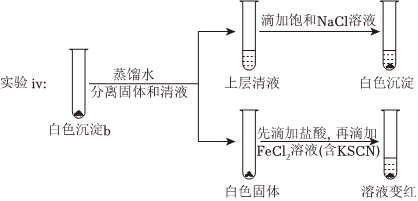
①設(shè)計(jì)對(duì)比實(shí)驗(yàn)證實(shí)白色沉淀b不只含有AgCl,實(shí)驗(yàn)方案和現(xiàn)象是。
②FeCl2溶液的作用是由此判斷,白色沉淀b可能含有AgClO。
(5)進(jìn)一步研究白色沉淀b和實(shí)驗(yàn)iii品紅溶液褪色慢的原因,進(jìn)行實(shí)驗(yàn)v: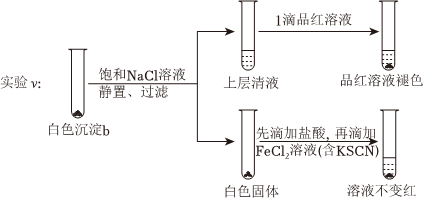
①?gòu)钠胶饨嵌冉忉尲尤腼柡蚇aCl溶液的目的。
②推測(cè)品紅溶液褪色的速率:實(shí)驗(yàn)iii比實(shí)驗(yàn)v(填“快”或“慢”)。組卷:12引用:1難度:0.5


