2017-2018學年湖南省長沙市長郡中學高二(上)第一次模塊化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共16小題,每小題3分,共48分.每小題只有一個選項符合題意)
-
1.下列說法不正確的是( )
A.一定溫度下的焓變在數值上等于變化過程中的等容熱效應 B.焓變的符號是△H C.焓變的單位通常是kJ/mol D.常溫下硝酸銨能夠溶于水,因為其溶于水是一個熵增大的過程 組卷:11引用:2難度:0.6 -
2.一定量的鹽酸跟過量的鐵粉反應時,為了減緩反應速率,且不影響生成氫氣的總量可向鹽酸中加入適量的( )
A.NaOH(固體) B.Fe( NO3)3溶液 C.NH4Cl(固體) D.CH3COONa(固體) 組卷:9引用:1難度:0.9 -
3.一定溫度下,體積相同、pH相同的H2SO4和CH3COOH溶液,與NaOH溶液中和時,兩者消耗的NaOH的物質的量( )
A.一樣多 B.H2SO4消耗NaOH多 C.CH3COOH消耗NaOH多 D.無法比較 組卷:3引用:1難度:0.6 -
4.25℃時,水的電離達到平衡:H2O?H++OH-;△H>0,下列敘述正確的是( )
A.向水中加入稀氨水,平衡逆向移動,c(OH-)降低 B.將水加熱,KW增大,pH不變 C.向水中加入少量固體CH3COONa,平衡逆向移動,c(H+)降低 D.向水中加入少量固體硫酸氫鈉,c(H+)增大,KW不變 組卷:95引用:10難度:0.9 -
5.某溫度下,重水( D2O)的離子積常數為1.6×10-15,若用定義pH一樣規定pD=-lgc(D+),則在該溫度下,下列敘述正確的是( )
A.純凈的重水中,c(D+)?c(OD-)>1.0×10-14 B.l L溶解有0.01 mol DCl的重水溶液,其pD=2 C.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12 D.純凈的重水中,pD=7 組卷:138引用:6難度:0.5 -
6.向新制氯水中加入少量下列物質,能增強溶液漂白能力的是( )
A.碳酸鈣粉末 B.稀硫酸 C.氯化鈣溶液 D.二氧化硫水溶液 組卷:2027引用:30難度:0.5 -
7.已知
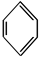 (b)、
(b)、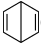 (d)、
(d)、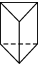 (p)的分子式均為C6H6,下列說法正確的是( )
(p)的分子式均為C6H6,下列說法正確的是( )A.b、d、p互為同分異構體,都屬于芳香烴 B.b、d、p的二氯代物均只有三種 C.b、d、p均可與酸性高錳酸鉀溶液反應 D.b、d、p中只有b的所有原子處于同一平面 組卷:23引用:2難度:0.8
二、非選擇題(本題共5小題,共52分)
-
20.航天員呼吸產生的CO2用下列反應處理,可實現空間站中O2的循環利用。
Sabatier反應:CO2(g)+4H2(g)?CH4(g)+2H2O(g);
水電解反應:2H2O(1)2H2(g)+O2(g)。電解
(1)將原料氣按nCO2:nH2=1:4置于密閉容器中發生 Sabatier反應,測得H2O(g)的物質的量分數與溫度的關系如圖所示(虛線表示平衡曲線)。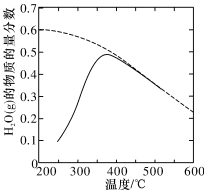
①該反應的平衡常數K隨溫度升高而(填“增大”或“減小”)。
②溫度過高或過低均不利于該反應的進行,原因是。
(2)Sabatier反應在空間站運行時,下列措施能提高CO2轉化效率的是(填字母代號)。
A.適當減壓 B.增大催化劑的比表面積 C.反應器前段加熱,后段冷卻
D.提高原料氣中CO2所占比例 E.合理控制反應器中氣體的流速
(3)一種新的循環利用方案是用Bosch反應CO2(g)+2H2(g)?C(s)+2H2O(g)代替Sabatier反應。
①已知CO2(g)、H2O(g)的生成焓分別為-394 kJ?mol-1、-242 kJ?mol-1,Bosch反應的△H=kJ?mol-1.(生成焓指一定條件下由對應單質生成1mol化合物時的反應熱)
②一定條件下Bosch反應必須在高溫下才能啟動,原因是。
③新方案的優點是。組卷:4引用:1難度:0.7 -
21.為有效控制霧霾,各地積極采取措施改善大氣質量.研究并有效控制空氣中氮氧化物、碳氧化物含量顯得尤為重要.
Ⅰ.氮氧化物研究
(1)一定條件下,將2molNO與2molO2置于恒容密閉容器中發生反應:2NO(g)+O2(g)?2NO2(g),下列各項能說明該反應達到平衡狀態的是.
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.NO和O2的物質的量之比保持不變 d.每消耗1molO2,同時生成2molNO2
(2)在T1、T2溫度下,一定量的NO發生分解反應時N2的體積分數隨時間變化如圖1所示,根據圖象判斷反應N2(g)+O2(g)?2NO(g)的△H0(填“>”或“<”).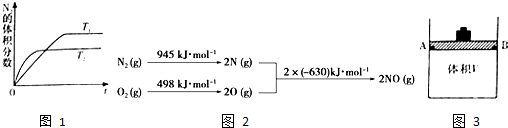
(3)NOx是汽車尾氣中的主要污染物之一.汽車發動機工作時會引發N2和O2反應,其能量變化示意圖如圖2:出該反應的熱化學方程式:.
Ⅱ.碳氧化物研究
(1)在體積可變(活塞與容器之間的摩擦力忽略不計)的密閉容器如圖3所示,現將3molNH3和2molCO2放入容器中,移動活塞至體積V為2L,用鉚釘固定在A、B點,發生合成尿素的總反應如下:
CO(g)+2H2(g)?CH3OH(g)
測定不同條件、不同時間段內的CO的轉化率,得到如下數據:
①根據上表數據,請比較T1T2(選填“>”、“<”或“=”);T2℃下,第30min 時,a1=10min 20min 30min 40min T1 30% 55% 65% 65% T2 35% 50% a1 a2 ,該溫度下的化學平衡常數為.
②T2℃下,第40min時,拔去鉚釘(容器密封性良好)后,活塞沒有發生移動,再向容器中通入6molCO,此時v(正)v (逆)(選填“>”、“<”或“=”),判斷的理由是.
(2)一定條件下可用甲醇與CO反應生成醋酸消除CO污染.常溫下,將a mol/L的醋酸與b mol/LBa(OH)2溶液等體積混合,充分反應后,溶液中存在2c(Ba2+)=c(CH3COO-),則該混合溶液中醋酸的電離常數Ka=(用含a和b的代數式表示)組卷:31引用:5難度:0.5


