2021-2022學年黑龍江省大興安嶺實驗中學西校區高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意)
-
1.將純水加熱至較高溫度,下列敘述正確的是( )
A.水的離子積變大、pH變小、呈酸性 B.水的離子積變大、pH變小、呈中性 C.水的離子積變小、pH變大、呈堿性 D.水的離子積不變、pH不變、呈中性 組卷:341引用:132難度:0.9 -
2.下列物質,屬于強電解質的是( )
A.NH3?H2O B.H2O C.CH3COONH4 D.CH3COOH 組卷:36引用:8難度:0.9 -
3.下列說法正確的是( )
A.KW隨濃度的改變而改變 B.Ksp只與難溶電解質的性質和溫度有關,而與溶液中的離子濃度無關 C.對已達到化學平衡的反應,改變壓強,平衡常數(K)一定改變 D.一般情況下,一元弱酸HA的Ka 越大,表明該酸的酸性越弱 組卷:40引用:6難度:0.9 -
4.下列熱化學方程式中,ΔH能正確表示物質的燃燒熱的是( )
A.H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol12B.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)ΔH=-11 036 kJ/mol C.CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ/mol12D.C(s)+ O2(g)=CO(g)ΔH=-110.5 kJ/mol12組卷:30引用:5難度:0.7 -
 5.一定條件下進行反應 2X(g)+Y(g)?Z(s)+3W(g);△H<0.達到平衡后,t1時刻改變某一條件所得V-t圖象如圖,則改變的條件為( )
5.一定條件下進行反應 2X(g)+Y(g)?Z(s)+3W(g);△H<0.達到平衡后,t1時刻改變某一條件所得V-t圖象如圖,則改變的條件為( )A.增大壓強 B.升高溫度 C.加催化劑 D.增加生成物濃度 組卷:46引用:9難度:0.7 -
6.60℃時水的離子積Kw=3.2×10-14,則在60℃時,c(H+)=2×10-7mol?L-1的溶液( )
A.呈酸性 B.呈堿性 C.呈中性 D.無法判斷 組卷:231引用:5難度:0.8 -
7.下列說法正確的是( )
A.含有H+離子的溶液一定呈酸性 B.0.1mol/L KOH溶液和0.1mol/L氨水中,其c(OH-)相等 C.pH為1的鹽酸的c(H+)是pH為3的鹽酸的100倍 D.Na2CO3溶液中,c(Na+)是c(CO32-)的兩倍 組卷:8引用:1難度:0.7 -
8.25℃時,pH=2的HCl溶液中,由水電離出的H+濃度是( )
A.1×10-7mol?L-1 B.1×10-12mol?L-1 C.1×10-2mol?L-1 D.1×10-14mol?L-1 組卷:240引用:27難度:0.9 -
9.表是常溫下某些一元弱酸的電離常數:則0.1 mol?L-1的下列溶液中,pH最小的是( )
弱酸 HCN HF CH3COOH HNO2 電離常數 4.9×10-10 7.2×10-4 1.8×10-5 6.4×10-6 A.HF B.HCN C.CH3COOH D.HNO2 組卷:45引用:3難度:0.7
二、填空題
-
 27.一定溫度下,在容積為1L的密閉容器內放入2mol N2O4和8mol NO2,發生如下反應:2NO2(紅棕色)?N2O4(無色)(△H<0),反應中NO2、N2O4的物質的量隨反應時間變化的曲線如圖,按下列要求作答:
27.一定溫度下,在容積為1L的密閉容器內放入2mol N2O4和8mol NO2,發生如下反應:2NO2(紅棕色)?N2O4(無色)(△H<0),反應中NO2、N2O4的物質的量隨反應時間變化的曲線如圖,按下列要求作答:
(1)在該溫度下,反應的化學平衡常數表達式為:
(2)若t1=10s,t2=20s,計算從t1至t2時以N2O4表示的反應速率:mol?L-1?s-1
(3)圖中t1、t2、t3哪一個時刻表示反應已經達到平衡?答:
(4)t1時,正反應速率(填“>”、“<”或“=”)逆反應速率
(5)維持容器的溫度不變,若縮小容器的體積,則平衡向移動 (填“正反應方向”、“逆反應方向”或“不移動”)
(6)維持容器的體積不變,升高溫度,達到新平衡時體系的顏色(填“變深”、“變淺”或“不變”)組卷:111引用:7難度:0.5
三、實驗題
-
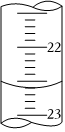 28.某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:
28.某課外興趣小組欲測定某NaOH溶液的濃度,其操作步驟如下:
①將堿式滴定管用蒸餾水洗凈后,用待測溶液潤洗后,再注入待測溶液,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0“刻度以下的位置,記下讀數;將錐形瓶用蒸餾水洗凈后,用待測溶液潤洗錐形瓶2~3次;從堿式滴定管中放入25.00mL待測溶液到錐形瓶中。
②將酸式滴定管用蒸餾水洗凈后,立即向其中注入0.1000mol/L標準鹽酸,調節滴定管的尖嘴部分充滿溶液,并使液面處于“0“刻度以下的位置,記下讀數。
③向錐形瓶中滴入酚酞作指示劑,進行滴定。滴定至指示劑剛好變色,且并不馬上變色為止,測得所耗鹽酸的體積為V1mL。
④重復以上過程,但在滴定過程中向錐形瓶加入5mL的蒸餾水,測得所耗鹽酸的體積為V2mL.試回答下列問題:
(1)錐形瓶中的溶液從色變為色時,停止滴定。
(2)滴定時邊滴邊搖動錐形瓶,眼睛應觀察
A、滴定管內液面的變化 B、錐形瓶內溶液顏色的變化
(3)該小組在步驟①中的錯誤是由此造成的測定結果(偏高、偏低或無影響)
(4)步驟②缺少的操作是。
(5)如圖,是某次滴定時的滴定管中的液面,其讀數為mL
(6)
請計算待測燒堿溶液的濃度滴定次數 待測液體積(mL) 標準鹽酸體積(mL) 滴定前度數(mL) 滴定后度數(mL) 第一次 25.00 0.50 20.40 第二次 25.00 4.00 24.10 mol/L。組卷:145引用:11難度:0.5


