2022-2023學(xué)年山東省濟(jì)南市歷城二中高三(上)一輪復(fù)習(xí)化學(xué)試卷
發(fā)布:2024/9/6 1:0:8
一、單選題(每小題只有一個選項符合題目要求,20分)
-
1.已知反應(yīng):2FeCr2O4+7Na2O2
4Na2CrO4+X+3Na2O,下列說法錯誤的是( )高溫A.X的化學(xué)式為Fe2O3 B.Na2O2發(fā)生氧化反應(yīng) C.Na2O2、Na2O均可與CO2反應(yīng) D.每生成18.6gNa2O反應(yīng)中轉(zhuǎn)移1.4mol電子 組卷:51引用:3難度:0.6 -
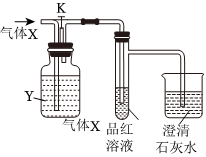 2.如圖是一套檢驗氣體性質(zhì)的實驗裝置圖。向裝置中緩慢通入氣體X,若關(guān)閉活塞K,則品紅溶液無變化,而澄清石灰水變渾濁;若打開活塞K,則品紅溶液褪色。據(jù)此判斷氣體X和洗氣瓶內(nèi)溶液Y可能是( )
2.如圖是一套檢驗氣體性質(zhì)的實驗裝置圖。向裝置中緩慢通入氣體X,若關(guān)閉活塞K,則品紅溶液無變化,而澄清石灰水變渾濁;若打開活塞K,則品紅溶液褪色。據(jù)此判斷氣體X和洗氣瓶內(nèi)溶液Y可能是( )A B C D X SO2 SO2 CO2 Cl2 Y 飽和NaHCO3溶液 濃硫酸 Na2SO3溶液 Na2SO3溶液 A.A B.B C.C D.D 組卷:7引用:1難度:0.6 -
3.NA為阿伏加德羅常數(shù)的值。下列說法錯誤的是( )
A.2.0gH218O與D216O的混合物中含有的中子數(shù)為NA B.標(biāo)準(zhǔn)狀況下2.24LCl2溶于水時,所得溶液中含氯微粒總數(shù)為0.2NA C.1molNH4F中含有的共價鍵數(shù)為4NA D.3molNO2與H2O完全反應(yīng)時轉(zhuǎn)移電子數(shù)目為2NA 組卷:276引用:11難度:0.6 -
4.下列實驗操作、現(xiàn)象及得出的結(jié)論均正確的是( )
選項 實驗操作 實驗現(xiàn)象 實驗結(jié)論 A 向某溶液中先加入氯化鋇溶液,再滴入鹽酸 先產(chǎn)生白色沉淀,后白色沉淀不消失 該溶液中一定含有 SO2-4B 向某溶液中加入氫氧化鈉溶液,將濕潤的紅色石蕊試紙置于試管口 試紙不變藍(lán) 該溶液中一定無 NH+4C 在0.1mol?L-1K2S溶液中滴加少量等濃度的ZnSO4溶液,再加入少量等濃度的CuSO4溶液 先產(chǎn)生白色沉淀,后產(chǎn)生黑色沉淀 Ksp(ZnS)>Ksp(CuS) D 室溫下,用pH試紙分別測定濃度均為0.1mol?L-1的Na2SO3和NaHSO3兩種溶液的pH pH:Na2SO3>NaHSO3 結(jié)合H+能力比HSO-3的弱SO2-3A.A B.B C.C D.D 組卷:30引用:3難度:0.5 -
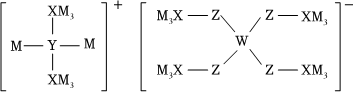 5.某多孔儲氫材料結(jié)構(gòu)如圖,M、W、X、Y、Z五種短周期元素原子序數(shù)依次增大,Z比Y的原子序數(shù)大9。下列說法正確的是( )
5.某多孔儲氫材料結(jié)構(gòu)如圖,M、W、X、Y、Z五種短周期元素原子序數(shù)依次增大,Z比Y的原子序數(shù)大9。下列說法正確的是( )A.第一電離能:Z>Y B.最高價氧化物對應(yīng)的水化物酸性:Y>X C.簡單氫化物的沸點(diǎn):X>Y D.M、Y、Z不能形成離子化合物 組卷:38引用:3難度:0.5 -
6.化學(xué)在生產(chǎn)、生活中起著重要的作用:
①明礬在水中可形成膠體,對水體進(jìn)行殺菌凈化;
②為了增強(qiáng)補(bǔ)鐵藥品的效果,可伴隨維生素C共同使用;
③用米湯可檢驗加碘食鹽中是否含有碘元素;
④將氯氣通入氫氧化鈣溶液反應(yīng)制得漂白粉;
⑤侯氏制堿法中利用物質(zhì)溶解度的不同,在液相中析出純堿固體;
⑥復(fù)合膨松劑中常含酸性物質(zhì),可提高膨松效果。
其中敘述正確的個數(shù)有( )A.1項 B.2項 C.3項 D.4項 組卷:45引用:3難度:0.7
三、填空題
-
19.摻雜硒的納米氧化亞銅催化劑可用于工業(yè)上合成甲醇,其反應(yīng)為CO(g)+2H2(g)?CH3OH(g)ΔH=akJ?mol-1。已知:v正=k正?c(CO)?c2(H2),v逆=k逆?c(CH3OH),其中k正、k逆為速率常數(shù),c為各組分的物質(zhì)的量濃度。回答下列問題:
(1)若按=1的投料比將H2與CO充入VL的剛性恒容密閉容器中,在一定條件下發(fā)生反應(yīng),測定CO的平衡轉(zhuǎn)化率與溫度、壓強(qiáng)的關(guān)系如圖甲所示。n(H2)n(CO)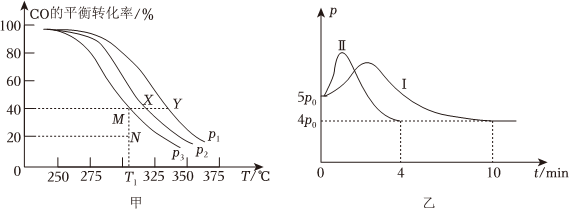
①壓強(qiáng)p1、p2、p3由小到大的順序是。
②T1℃,若向該容器中充入3.0mol H2和3.0mol CO發(fā)生上述反應(yīng),5min后反應(yīng)達(dá)到平衡(M點(diǎn)),則0~5min內(nèi),v(H2)=mol?L-1?min-1,則N點(diǎn)的=k逆k正。
③X、Y、M、N四點(diǎn),平衡常數(shù)從大到小關(guān)系是。
(2)若向起始溫度為325℃的10L剛性恒容密閉容器中充入2mol CO和3mol H2,發(fā)生反應(yīng),體系總壓強(qiáng)(p)與時間(t)的關(guān)系如圖乙中曲線Ⅰ所示;曲線Ⅱ為只改變某一條件的變化曲線,曲線中平衡溫度與起始溫度相同。
①曲線Ⅱ所對應(yīng)的改變的條件可能為。
②體系總壓強(qiáng)先增大后減小的原因為。
③該條件下H2的平衡轉(zhuǎn)化率為%。(結(jié)果保留一位小數(shù))組卷:32引用:2難度:0.5 -
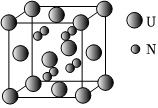 20.鈾氮化合物是核燃料循環(huán)系統(tǒng)中的重要材料。
20.鈾氮化合物是核燃料循環(huán)系統(tǒng)中的重要材料。
已知3(NH4)4[UO2(CO3)3]3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列問題:800℃
(1)基態(tài)氮原子價電子軌道表示式為。
(2)反應(yīng)中斷裂的化學(xué)鍵有(填標(biāo)號)。
a.氫鍵
b.極性鍵
c.非極性鍵
d.離子鍵
e.配位鍵
(3)反應(yīng)所得的氣態(tài)產(chǎn)物中屬于非極性分子的是(填化學(xué)式,下同);氫化物中更易與Cu2+形成配離子的是,解釋原因。
(4)基態(tài)U原子的外圍電子排布式為5f36d17s2,則處于下列狀態(tài)的鈾原子或離子失去一個電子所需能量最高的是(填標(biāo)號)。
a.5f36d17s1
b.5f37s27p1
c.5f26d27s2
d.5f47s2
(5)的空間構(gòu)型為CO2-3,其結(jié)構(gòu)中存在大π鍵,可表示為(用πmn表示,m代表參與形成大π鍵的原子數(shù),n代表參與形成大π鍵的電子數(shù))。
(6)某種鈾氮化物的晶胞如圖。已知晶胞密度為dg?cm-3,U原子半徑為r1nm,N原子半徑為r2nm,設(shè)NA為阿伏加德羅常數(shù)的值,則該晶胞的空間利用率為(用含d、r1、r2、NA的式子表示)。組卷:63引用:3難度:0.5


