2022-2023學年北京交大附中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意,本題共19小題,每小題2分,共42分)
-
1.我國酒文化源遠流長.下列古法釀酒工藝中,以發生化學反應為主的過程是( )
A.酒曲搗碎 B.酒曲發酵 C.高溫蒸餾 D.泉水勾兌 



A.A B.B C.C D.D 組卷:44引用:9難度:0.9 -
2.對下列物質:①純堿②食鹽水③濃硫酸④燒堿 ⑤液態氧⑥氯酸鉀,分類全部正確的是( )
A.堿--①④ B.純凈物--③④⑤ C.混合物--②⑤ D.鹽--①⑥ 組卷:32引用:4難度:0.9 -
 3.KOH是我國古代紡織業常用于漂洗的洗滌劑。古代制取KOH的流程如圖。上述流程中沒有涉及的化學反應類型是( )
3.KOH是我國古代紡織業常用于漂洗的洗滌劑。古代制取KOH的流程如圖。上述流程中沒有涉及的化學反應類型是( )A.化合反應 B.分解反應 C.置換反應 D.復分解反應 組卷:234引用:17難度:0.5 -
4.下列關于膠體的敘述中,不正確的是( )
A.用半透膜除去氫氧化鐵膠體中的Na+、Cl- B.膠體中分散質粒子的直徑在1nm~100nm之間 C.利用丁達爾效應可以區分溶液和膠體 D.用濾紙能分離膠體和溶液 組卷:23引用:3難度:0.7 -
5.下列電離方程式錯誤的是( )
A.Al2(SO4)3=2Al3++3 SO2-4B.NaHCO3=Na++H++ CO2-3C.Ba(OH)2=Ba2++2 OH- D.Na2CO3=2Na++ CO2-3組卷:54引用:3難度:0.9 -
6.有如下物質:①NaCl溶液;②熔融MgCl2;③CuSO4固體;④NaOH固體;⑤金屬銅;⑥蔗糖。有關它們的說法正確的是( )
A.屬于非電解質的有①⑤⑥ B.不能導電的有③④⑥ C.屬于電解質的有①②③④ D.屬于混合物的有①②③⑥ 組卷:121引用:3難度:0.6 -
7.下列裝置用于實驗室制Cl2并回收MnCl2的實驗,能達到實驗目的的是( )

A.用裝置甲制取Cl2 B.用裝置乙除去Cl2中混有的少量HCl C.用裝置丙分離MnO2和MnCl2溶液 D.用裝置丁蒸干MnCl2溶液制得MnCl2?4H2O 組卷:34引用:2難度:0.5 -
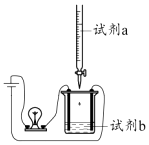 8.用如圖所示裝置(攪拌裝置已略去)探究溶液中離子濃度的變化,燈光變化不可能出現“亮→暗(或滅)→亮”現象的是( )
8.用如圖所示裝置(攪拌裝置已略去)探究溶液中離子濃度的變化,燈光變化不可能出現“亮→暗(或滅)→亮”現象的是( )A B C D 試劑a NaOH Ca(OH)2 Ba(OH) 2 H2SO3 試劑b CH3COOH Ca(HCO3)2 H2SO4 H2S A.A B.B C.C D.D 組卷:79引用:2難度:0.7
二、解答題(共6小題,滿分58分)
-
26.某小組同學用圖1裝置研究去除Cl2的方法,并探究不銹鋼制的注射器針頭出現異常現象的原因。
I.研究去除Cl2的方法
(1)實驗i說明NaOH溶液可以吸收Cl2,用離子方程式解釋原理: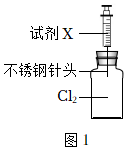
實驗序號 注射器中試劑X 實驗現象 瓶內液面上方 3分鐘時不銹鋼針頭 i 2mLNaOH溶液 無色 無明顯變化 ii 2mL水 黃綠色略變淺 表面附著黃色物質 。
(2)取實驗ii中針頭表面黃色物質,加水溶解,滴加少量KSCN溶液,觀察到,證明針頭中Fe被氧化為Fe3+。
II.探究不銹鋼針頭出現黃色物質的原因
小組同學提出了如下3種假設。
假設1:Fe被干燥的Cl2氧化為Fe3+;
假設2:Fe被氯水中的HClO氧化為Fe3+;
假設3:Fe被氯水中的H+氧化為Fe2+,。
(3)補全假設3:。
(4)小組同學用圖1裝置進行實驗iii證明假設1不成立。實驗iii的操作及現象為。
(5)小組同學進行實驗iv,驗證假設2和假設3。
實驗iv:分別向pH相同的鹽酸和氯水中加入足量的鐵粉,記錄反應過程中溶液pH的變化,如圖2所示。
已知:pH相同的溶液中,c(H+)相同;pH越大,c(H+)越小。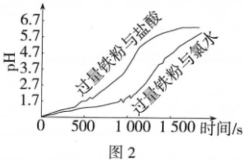
①補全假設2中反應的離子方程式:Fe+HClO+═++。
②根據圖2數據推測假設2可能成立,理由是。組卷:66引用:3難度:0.5 -
27.KMnO4在實驗室和工業上均有重要應用,其工業制備的部分工藝如下:
Ⅰ.將軟錳礦(主要成分MnO2)粉碎后,與KOH固體混合,通入空氣充分焙燒,生成暗綠色熔融物。
Ⅱ.冷卻,將固體研細,用稀KOH溶液浸取,過濾,得暗綠色溶液。
Ⅲ.向暗綠色溶液中通入CO2,溶液變為紫紅色,同時生成黑色固體。
Ⅳ.過濾,將紫紅色溶液蒸發濃縮,冷卻結晶,過濾,洗滌,干燥,得KMnO4固體。
資料:K2MnO4為暗綠色固體,在強堿性溶液中穩定,在近中性或酸性溶液中易發生歧化反應(Mn的化合價既升高又降低)。
(1)Ⅰ中,軟錳礦(主要成分MnO2)提純后可用于實驗室制取氯氣,反應的離子方程式為:。
(2)Ⅰ中,生成K2MnO4的化學方程式是。
(3)Ⅱ中,浸取時用稀KOH溶液的原因是。
(4)Ⅲ中,CO2和K2MnO4在溶液中反應的化學方程式是。
(5)將K2MnO4溶液采用惰性電極隔膜法電解,也可制得KMnO4。裝置如圖: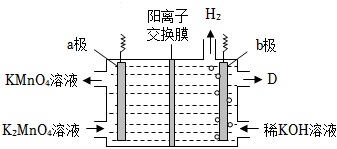
a極發生(填“氧化”或“還原”)反應;判斷依據是:。
(6)用滴定法測定某高錳酸鉀產品的純度,步驟如下:
已知:Na2C2O4+H2SO4═H2C2O4+Na2SO4
5H2C2O4+2+6H+═2Mn2++10CO2↑+8H2OMnO-4
摩爾質量:Na2C2O4134g?mol-1、KMnO4158g?mol-1;Mn2+顏色為肉粉色。
ⅰ.稱取ag產品,配成50mL溶液。
ⅱ.稱取bgNa2C2O4,置于錐形瓶中,加蒸餾水使其溶解,再加入過量的硫酸。
ⅲ.將錐形瓶中溶液加熱到75℃~80℃,恒溫,用ⅰ中所配溶液滴定至(填現象),消耗溶液VmL(雜質不參與反應)。則產品中KMnO4的質量分數的表達式為:。組卷:13引用:1難度:0.3


