2020-2021學(xué)年黑龍江省牡丹江市海林市朝鮮族中學(xué)高二(下)月考化學(xué)試卷(5月份)
發(fā)布:2024/11/14 14:30:2
一、單選題(每小題3分,共45分)
-
1.設(shè)NA為阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )
A.標(biāo)準(zhǔn)狀況下,4.48 L H2O含有的電子數(shù)為2NA B.56 g聚乙烯中含有碳碳雙鍵的數(shù)目為2NA C.標(biāo)準(zhǔn)狀況下,14 g CO與11.2 L SO3所含分子數(shù)均為NA D.1 L 0.2 mol/L的K2C2O4溶液中C2O42-的數(shù)目小于 0.2 NA 組卷:10引用:1難度:0.6 -
2.設(shè)NA是阿伏加德羅常數(shù)的值。下列說(shuō)法正確的是( )
A.18 g重水所含電子的數(shù)目為10NA B.所含共價(jià)鍵的數(shù)目均為0.6NA的白磷和甲烷的物質(zhì)的量相等 C.常溫常壓下,46 gC7H8和C3H8O3的混合物中含H原子數(shù)目為4NA D.電解精煉銅時(shí),當(dāng)電路中通過(guò)NA個(gè)電子,陽(yáng)極溶解32 g銅 組卷:10引用:1難度:0.6 -
3.在某100mL混合液中,HNO3和H2SO4的物質(zhì)的量濃度分別是0.4mol?L-1和0.1mol?L-1.向該混合液中加入1.92g銅粉,加熱,待充分反應(yīng)后,設(shè)溶液的體積仍為100mL,則所得溶液中的Cu2+的物質(zhì)的量濃度是( )
A.0.15 mol?L-1 B.0.225 mol?L-1 C.0.35 mol?L-1 D.0.45 mol?L-1 組卷:122引用:14難度:0.7 -
4.某研究性學(xué)習(xí)小組欲分析某礦石的主要成分,粉碎后將其溶于過(guò)量稀鹽酸充分反應(yīng),過(guò)濾后用所得濾液進(jìn)行如下實(shí)驗(yàn),下列說(shuō)法正確的是( )
A.取少量濾液向其中滴加少量Na2CO3溶液,無(wú)白色沉淀,說(shuō)明礦石中一定不含Ca2+ B.取少量濾液向其中滴加過(guò)量的氨水,白色沉淀逐漸增多,然后漸漸溶解,說(shuō)明礦石中含有Al3+ C.取少量濾液向其中滴加過(guò)量BaCl2溶液,產(chǎn)生白色沉淀,說(shuō)明礦石中含有SO42? D.取少量濾液向其中先通入少量Cl2,再滴加KSCN溶液,溶液變紅色,說(shuō)明礦石中一定含有Fe2+ 組卷:11引用:1難度:0.7 -
5.實(shí)驗(yàn)室用NaClO固體配制500mL 4mol?L-1NaClO消毒液,下列說(shuō)法正確的是( )
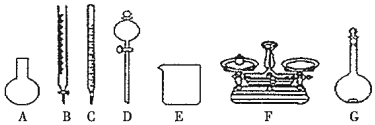
A.如圖所示的儀器中,有四種是不需要的,還需一種玻璃儀器即可 B.容量瓶用蒸餾水洗凈后,應(yīng)烘干后才能用于配制溶液 C.用放置時(shí)間較長(zhǎng)NaClO來(lái)配制溶液,可能導(dǎo)致所配溶液濃度偏低 D.定容時(shí),俯視容量瓶刻度線,會(huì)導(dǎo)致所配溶液濃度偏低 組卷:8引用:3難度:0.6 -
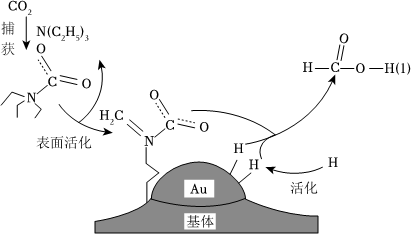 6.捕獲二氧化碳生成甲酸的過(guò)程如圖所示。設(shè)NA為阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )
6.捕獲二氧化碳生成甲酸的過(guò)程如圖所示。設(shè)NA為阿伏加德羅常數(shù)的值,下列說(shuō)法正確的是( )A.在捕獲過(guò)程中,若有22.4L CO2參與反應(yīng),則在反應(yīng)過(guò)程中CO2分子只拆開了2NA對(duì)電子對(duì) B.已知N(C2H5)3的性質(zhì)與NH3類似,0.1mol N(C2H5)3與鹽酸恰好完全反應(yīng)生成的鹽溶液中[N(C2H5)3H]+的數(shù)目為0.1NA C.1000L pH=3的甲酸溶液中,陰離子數(shù)目為NA D.每生成0.5mol甲酸,轉(zhuǎn)移的電子數(shù)為2NA 組卷:9引用:1難度:0.5 -
7.能正確表示下列反應(yīng)的離子方程式為( )
A.過(guò)量CO2通入澄清的石灰水::Ca2++2OH-+CO2═CaCO3↓+H2O B.向CuSO4溶液中通入H2S:H2S+Cu2+═CuS↓+2H+ C.向碘化鉀溶液中加入少量酸性雙氧水:3H2O2+I-═IO3-+3H2O D.向飽和碳酸鈉溶液中通入足量CO2:CO32-+2CO2+H2O═2HCO3- 組卷:17引用:1難度:0.6
二、填空題(共47分)
-
22.在Na+濃度為0.5mol/L的某澄清溶液中,還可能含有下表中的若干種離子:
取該溶液100mL進(jìn)行如下實(shí)驗(yàn)(氣體體積在標(biāo)準(zhǔn)狀況下測(cè)定):陽(yáng)離子 K+、Ag+、Mg2+、Ba2+ 陰離子 、NO-3、CO2-3、SiO2-3SO2-4
試回答下列問題:序號(hào) 實(shí)驗(yàn)內(nèi)容 實(shí)驗(yàn)結(jié)果 Ⅰ 向該溶液中加入足量稀鹽酸 產(chǎn)生白色沉淀并放出0.56L氣體 Ⅱ 將Ⅰ的反應(yīng)混合液過(guò)濾,對(duì)沉淀洗滌、
灼燒至恒重,稱量所得固體質(zhì)量固體質(zhì)量為2.4g Ⅲ 在Ⅱ的濾液中滴加BaCl2溶液 無(wú)明顯現(xiàn)象
(1)實(shí)驗(yàn)Ⅰ能確定一定不存在的陽(yáng)離子是.
(2)通過(guò)實(shí)驗(yàn)Ⅰ、Ⅱ、Ⅲ和必要計(jì)算,填寫下表中陰離子的濃度(能計(jì)算出的,填寫計(jì)算結(jié)果,一定不存在的離子填“0”,不能確定是否存在的離子填“?”)
(3)判斷K+是否存在,若存在求其最小濃度,若不存在說(shuō)明理由陰離子 NO-3CO2-3SiO2-3SO2-4c/mol?L-1 .組卷:56引用:10難度:0.1
三、計(jì)算題(共8分)
-
23.空氣中含有少量臭氧(O3)可以起到消毒、殺菌的作用。但臭氧過(guò)量會(huì)對(duì)人體有害。我國(guó)的環(huán)境空氣質(zhì)量標(biāo)準(zhǔn)對(duì)空氣中臭氧的最高濃度(單位體積的空氣中所含臭氧的質(zhì)量)限值如下表所示:
臭氧與KI溶液反應(yīng),生成1種可使帶火星木條復(fù)燃的氣體,反應(yīng)后的溶液能使酚酞試液變紅,也能使蘸有淀粉溶液的濾紙條變藍(lán)。為測(cè)定某地臭氧的含量,將50m3的空氣通過(guò)足量的KI溶液,使臭氧完全反應(yīng),在所得溶液中再加入適量的Na2S2O3溶液(含Na2S2O3的質(zhì)量為47.4mg)。恰好完全反應(yīng)(2Na2S2O3+I2═Na2S4O6+2NaI)。濃度限值(mg/m3) 一級(jí)標(biāo)準(zhǔn)0.12 二級(jí)標(biāo)準(zhǔn)0.16 三級(jí)標(biāo)準(zhǔn)0.20
(1)O3與KI反應(yīng)的化學(xué)方程式:。
(2)通過(guò)計(jì)算確定該地區(qū)空氣中臭氧濃度的級(jí)別。組卷:3引用:1難度:0.6


