2020年北京市高考化學(xué)等級考試模擬試卷(一)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.我國太陽能開發(fā)利用位于世界前列。下列采用“光-熱-電”能量轉(zhuǎn)換形式的是( )
A. 
光致(互變異構(gòu))儲能B. 
生產(chǎn)甲醇燃料C. 
太陽能熔鹽發(fā)電D. 
太陽能空間發(fā)電組卷:86引用:2難度:0.6 -
2.反應(yīng)NH4Cl+NaNO2═NaCl+N2↑+2H2O放熱且產(chǎn)生氣體,可用于冬天石油開采。下列表示反應(yīng)中相關(guān)微粒的化學(xué)用語正確的是( )
A.中子數(shù)為18的氯原子: Cl1817B.N2的結(jié)構(gòu)式:N═N C.Na+的結(jié)構(gòu)示意圖: 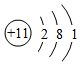
D.H2O的電子式: 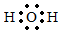 組卷:739引用:39難度:0.7
組卷:739引用:39難度:0.7 -
3.廚房中有很多調(diào)味品,它們可以補充食品在加工過程中失去的味道、增強原有的味道或添加一些額外的味道。下列說法不正確的是( )
A.醋能增加食品的酸味,還具有防腐作用 B.人體需控制食鹽攝入量,以降低患高血壓的風(fēng)險 C.味精的主要成分是谷氨酸的鈉鹽,谷氨酸屬于氨基酸 D.白砂糖的主要成分是蔗糖,蔗糖屬于天然高分子化合物 組卷:137引用:6難度:0.7 -
4.阿伏加德羅常數(shù)的值為NA,下列說法正確的是( )
A.1 mol 甲烷分子中含有的碳氫鍵數(shù)目為4 NA B.1 mol Na2O2與足量水反應(yīng),轉(zhuǎn)移的電子數(shù)為2 NA C.標準狀況下,2.24 L N2和O2的混合氣體中分子數(shù)為0.2 NA D.密閉容器中,2 mol SO2和1 mol O2催化反應(yīng)后分子總數(shù)為2 NA 組卷:56引用:2難度:0.7 -
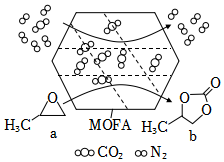 5.常溫常壓下,某金屬有機多孔材料(MOFA)對CO2具有超高的吸附能力,并能催化CO2與環(huán)氧丙烷的反應(yīng),其工作原理如圖所示。下列說法錯誤的是( )
5.常溫常壓下,某金屬有機多孔材料(MOFA)對CO2具有超高的吸附能力,并能催化CO2與環(huán)氧丙烷的反應(yīng),其工作原理如圖所示。下列說法錯誤的是( )A.該催化劑不能提高反應(yīng)物的平衡轉(zhuǎn)化率 B.b的一氯代物有3種 C.a(chǎn)生成b的反應(yīng)類型為取代反應(yīng),并有極性共價鍵形成 D.該材料的吸附作用具有選擇性,利用此法可減少CO2的排放 組卷:23引用:1難度:0.6 -
6.食鹽、醋酸、84消毒液(主要成分為NaClO)、酒精等是災(zāi)后經(jīng)常使用的物質(zhì),下列用于解釋事實的方程式書寫不正確的是( )
A.電解NaCl溶液時,陰極區(qū)pH增大的原因:2H2O+2e-═2OH-+H2↑ B.醋酸顯酸性的原因:CH3COOH═CH3COO-+H+ C.84消毒液顯堿性的原因:ClO-+H2O?HClO+OH- D.醋酸和乙醇發(fā)生酯化反應(yīng)的化學(xué)方程式:CH3COOH+C2H5OH CH3COOC2H5+H2O濃硫酸△組卷:26引用:1難度:0.7
二、解答題(共5小題,滿分58分)
-
18.草酸亞鐵是黃色晶體,常用作照相顯影劑、新型電池材料等。
實驗室制備草酸亞鐵并測定其中Fe2+和C2O42-的物質(zhì)的量之比確定其純度,步驟如下:
Ⅰ.稱取一定質(zhì)量的硫酸亞鐵銨[(NH4)2Fe(SO4)2]于燒杯中,加蒸餾水和稀硫酸,加熱溶解,再加飽和H2C2O4溶液,加熱沸騰數(shù)分鐘,冷卻、過濾、洗滌、晾干,得黃色晶體。
Ⅱ.稱取m gⅠ中制得的晶體于錐形瓶中,加入過量稀硫酸使其溶解,70℃水浴加熱,用c mol?L-1 KMnO4溶液滴定至終點,消耗KMnO4溶液v1 mL(其中所含雜質(zhì)與KMnO4不反應(yīng))。
Ⅲ.向Ⅱ滴定后的溶液中加入過量鋅粉和稀硫酸,煮沸,至反應(yīng)完全,過濾,用c mol?L-1 KMnO4溶液滴定濾液至終點,消耗KMnO4溶液v2 mL。
Ⅳ.重復(fù)上述實驗3次,計算。
已知:ⅰ.草酸是弱酸。
ⅱ.pH>4時,F(xiàn)e2+易被O2氧化。
ⅲ.酸性條件下,KMnO4溶液的還原產(chǎn)物為近乎無色的Mn2+。
(1)Ⅰ中加入稀硫酸的目的是、。
(2)Ⅱ中與KMnO4溶液反應(yīng)的微粒是、。
(3)Ⅲ中加入過量鋅粉僅將Fe3+完全還原為Fe2+.若未除凈過量鋅粉,則消耗KMnO4溶液的體積Vv2 mL(填“>”、“=”或“<”)。
(4)Ⅲ中,滴定時反應(yīng)的離子方程式是。
(5)m gⅠ中制得的晶體中,F(xiàn)e2+和C2O42-的物質(zhì)的量之比是(用含v1、v2的計算式表示)。組卷:59引用:5難度:0.5 -
19.某小組在驗證反應(yīng)“Fe+2Ag+=Fe2++2Ag”的實驗中檢測到Fe3+,發(fā)現(xiàn)和探究過程如下。
向硝酸酸化的0.05mol?L-1硝酸銀溶液(pH≈2)中加入過量鐵粉,攪拌后靜置,燒杯底部有黑色固體,溶液呈黃色。
(1)檢驗產(chǎn)物
①取少量黑色固體,洗滌后,(填操作和現(xiàn)象),證明黑色固體中含有Ag。
②取上層清液,滴加K3[Fe(CN)6]溶液,產(chǎn)生藍色沉淀,說明溶液中含有。
(2)針對“溶液呈黃色”,甲認為溶液中有Fe3+,乙認為鐵粉過量時不可能有Fe3+,乙依據(jù)的原理是(用離子方程式表示)。針對兩種觀點繼續(xù)實驗:
①取上層清液,滴加KSCN溶液,溶液變紅,證實了甲的猜測。同時發(fā)現(xiàn)有白色沉淀產(chǎn)生,且溶液顏色變淺、沉淀量多少與取樣時間有關(guān),對比實驗記錄如下:
(資料:Ag+與SCN-生成白色沉淀AgSCN)序號 取樣時間/min 現(xiàn)象 ⅰ 3 產(chǎn)生大量白色沉淀;溶液呈紅色 ⅱ 30 產(chǎn)生白色沉淀;較3min時量少;溶液紅色較3min時加深 ⅲ 120 產(chǎn)生白色沉淀;較30min時量少;溶液紅色較3 0min時變淺
②對Fe3+產(chǎn)生的原因作出如下假設(shè):
假設(shè)a:可能是鐵粉表面有氧化層,能產(chǎn)生Fe3+;
假設(shè)b:空氣中存在O2,由于(用離子方程式表示),可產(chǎn)生Fe3+;
假設(shè)c:酸性溶液中具有氧化性,可產(chǎn)生Fe3+;NO-3
假設(shè)d:根據(jù)現(xiàn)象,判斷溶液中存在Ag+,可產(chǎn)生Fe3+。
③下列實驗Ⅰ可證實假設(shè)a、b、c不是產(chǎn)生Fe3+的主要原因。實驗Ⅱ可證實假設(shè)d成立。
實驗Ⅰ:向硝酸酸化的溶液(pH≈2)中加入過量鐵粉,攪拌后靜置,不同時間取上層清液滴加KSCN溶液,3min時溶液呈淺紅色,30min后溶液幾乎無色。
實驗Ⅱ:裝置如圖。其中甲溶液是,操作及現(xiàn)象是。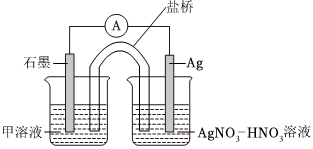
(3)根據(jù)實驗現(xiàn)象,結(jié)合方程式推測實驗ⅰ~ⅲ中Fe3+濃度變化的原因:。組卷:1215引用:19難度:0.5


