2021-2022學年江西省贛州市十六縣(市)十九校高一(下)期中化學試卷
發布:2025/1/3 3:0:2
一、選擇題本卷共15題,每小題只有一個選項符合題意要求,每小題3分共45分
-
1.《厲害了,我的國》展示了中國探索太空.開發深海,建設世界第一流的高鐵、橋梁、碼頭.5G技術聯通世界等取得的舉世矚目的成就.它們與化學有著密切聯系.下列說法正確的是( )
A.為打造生態文明建設,我國大力發展核電、光電、風電、水電,電能屬于不可再生能源 B.“神舟十一號”宇宙飛船返回艙外表面使用的高溫結構陶瓷的主要成分是硅酸鹽 C.我國提出網絡強國戰略,光纜線路總長超過三千萬公里.光纜的主要成分是晶體硅 D.C919大型客機使用了大量先進復合材料、鋁鋰合金等,鋁鋰合金可減輕機身自重 組卷:7引用:1難度:0.6 -
2.用NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.0.1mol/L的NH4NO3溶液中的氮原子數為0.2NA B.常溫常壓下,O2和O3的混合物共64g,所含氧原子數目一定為4NA C.標準狀況下22.4LNO與11.2LO2充分反應后氣體的分子數為0.1NA D.7.8gNa2O2與足量的CO2充分反應,反應中轉移的電子數為0.2NA 組卷:5引用:2難度:0.8 -
3.一定溫度下,將 2 mol SO2和 1 mol O2充入2L密閉容器中,在催化劑存在下進行下列反應:2SO2+O2 ?2SO3,下列說法中正確的是( )
A.達到反應限度時,生成2molSO3 B.達到反應限度時SO2的消耗速率必定等于O2的生成速率 C.達到反應限度時SO2、O2、SO3的分子數之比一定為2:1:2 D.SO2和SO3物質的量之和一定為 2mol 組卷:65引用:5難度:0.5 -
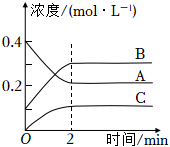 4.800℃時,A、B、C三種氣體在密閉容器中反應時濃度的變化如圖所示.則以下說法錯誤的是( )
4.800℃時,A、B、C三種氣體在密閉容器中反應時濃度的變化如圖所示.則以下說法錯誤的是( )A.發生的反應可表示為2A(g)?2B(g)+C(g) B.前2min,A的分解速率為0.2mol?L-1?min-1 C.2min時,A、B、C的濃度之比為2:3:1 D.通過調控反應條件,可以提高該反應進行的程度 組卷:9引用:3難度:0.5 -
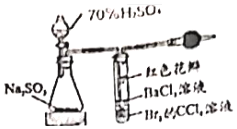 5.推理是一種重要的能力,打開分液漏斗活塞,進行如圖所示的探究實驗,對實驗現象的預測及分析錯誤的是( )
5.推理是一種重要的能力,打開分液漏斗活塞,進行如圖所示的探究實驗,對實驗現象的預測及分析錯誤的是( )A.錐形瓶中Na2SO3與70%硫酸發生氧化還原反應 B.試管內CCl4層溶液褪色,說明Br2具有氧化性 C.試管中的紅色花瓣褪色,說明SO2具有漂白性 D.一段時間后試管內有白色沉淀,說明有 生成SO2-4組卷:2引用:1難度:0.5 -
6.Y形管是一種特殊的儀器,與其他儀器組合可以進行某些實驗探究。利用如圖裝置可以探究SO2與BaCl2反應生成沉淀的條件。下列判斷正確的是( )
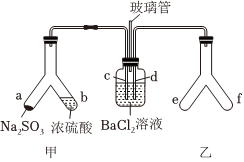
A.e、f兩管中的試劑可以分別是濃氨水和NaOH固體 B.玻璃管的作用是連通大氣,使空氣中的氧氣進入廣口瓶,參與反應 C.c、d兩根導管都必須插入BaCl2溶液中,保證氣體與Ba2+充分接觸 D.Y形管乙中產生的為氧化性氣體,將BaSO3氧化為BaSO4沉淀 組卷:139引用:6難度:0.5
二、非選擇題本卷共4大題,共55分
-
18.回答下列問題:
(1)氫氣是一種熱值高、環境友好型燃料.等物質的量的H2完全燃燒生成液態水與生成氣態水相比,生成液態水時放出熱量(填“多”“少”或“相等”)
(2)斷裂1mol共價鍵所吸收的能量或形成1mol共價鍵所釋放的能量稱為鍵能.已知H-H鍵能為436kJ/mol,H-N鍵能為391kJ/mol,N≡N鍵能為946kJ/mol。根據鍵能計算工業合成氨時消耗1molN2(填“吸收”或“放出”)kJ熱量。
(3)FeCl3溶液常用于腐蝕印刷電路銅板,發生反應的離子方程式為,若將此反應設計成原電池,則負極所用電極材料為。
(4)甲烷可以消除氮氧化物污染,如CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)。
①下列措施能夠使該反應速率加快的是(填序號,下同)。
a.使用催化劑
b.降低溫度
c.恒溫恒容下,充入氦氣
d.恒溫恒壓下,充入氦氣
②若上述反應在恒容的密閉容器中進行,下列敘述中不能說明該反應已達平衡狀態的是。
a.容器內氣體的壓強不再變化
b.容器中氣體的密度不變
c.c(NO2)═2c(N2)
d.2v正(CO2)═v逆(NO2)
e.混合氣體的平均相對分子質量不變
(5)甲烷可直接應用于燃料電池。其工作原理如圖所示: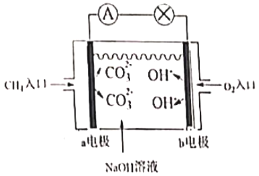
①甲烷通入的一極,電極反應式為:。
②當電路中累計有2mol電子通過時,消耗的氧氣的體積在標準狀況下為L。組卷:17引用:1難度:0.5 -
19.草酸與高錳酸鉀在酸性條件下能夠發生反應:
MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
通過下表實驗探究外界因素對反應速率的影響。
(1)該反應中氧化劑和還原劑的物質的量之比為實驗序號 實驗溫度/K 有關物質 溶液顏色褪至無色所需時間/s 酸性KMnO4溶液 H2C2O4溶液 H2O V/mL c/mol?L-1 V/mL c/mol?L-1 V/mL A 293 4 0.02 4 0.1 0 t1 B T1 4 0.02 3 0.1 V1 8 C 313 4 0.02 V2 0.1 1 t2 。
(2)其中T1=;V2=。
(3)若t1<8,則由實驗可得出的結論是;忽略溶液體積的變化,利用實驗B中的數據計算,0~8s內,用KMnO4的濃度變化表示的反應速率v(KMnO4)=。
(4)在實驗中,草酸(H2C2O4)溶液與KMnO4酸性溶液反應時,褪色總是先慢后快。
①同學們據此提出以下假設:
假設1:該反應為放熱反應
假設2:反應生成的Mn2+對該反應有催化作用
假設3:反應生成的K+或SO42-該反應有催化作用
丙同學認為假設3不合理,其理由是。
②丁同學用如下實驗證明假設2:除了酸性高錳酸鉀和草酸外,還需要選擇的試劑是。(填化學式)組卷:17引用:3難度:0.5


