2020-2021學年安徽省合肥市新東方學校高三(下)月考化學試卷0044
發布:2025/1/6 7:0:2
一、選擇題(共7小題,每小題3分,滿分21分)
-
1.陶瓷是中華文化的瑰寶之一,乾隆皇帝有詩云“暈如雨后霽霞紅,出火還加微炙工;世上朱砂非所擬,西方寶石致難同……”下列關于文中描述的說法正確的是( )
A.陶瓷絢麗的色彩可能源自某些金屬氧化物 B.陶瓷的主要成分為二氧化硅 C.陶瓷耐熱和抗壓能力均很差 D.陶瓷與寶石均屬于純凈物 組卷:7引用:1難度:0.6 -
2.下列說法正確的是( )
A.氯乙烯和聚氯乙烯互為同系物 B.可用碘水檢驗綿白糖是否混有淀粉 C.丙烯制成的無紡布屬于易降解的高聚物 D.蛋白質和油脂均主要用于供給人體能量 組卷:12引用:1難度:0.8 -
3.下列除雜(括號內為雜質)試劑和除雜方法均正確的是( )
選項 混合物 除雜試劑 除雜方法 A O2(N2) 足量還原鐵粉 加熱 B NO2(NH3) 足量稀H2SO4 洗氣 C NaCl(MgSO4) 適量Ba(OH)2溶液 過濾 D 苯(乙醇) CCl4 分液,蒸餾 A.A B.B C.C D.D 組卷:6引用:1難度:0.6
二、解答題(共3小題,滿分43分)
-
10.氮氧化物和碳氧化物的綜合利用備受矚目。
已知:Ⅰ.2N2(g)+O2(g)?2N2O(g)△H1=+339.3kJ?mol-1
Ⅱ.C(s)+CO2(g)?2CO(g)△H2=+172.5kJ?mol-1
Ⅲ.C(s)+O2(g)═CO2(g)△H3=-393.5kJ?mol-1
回答下列問題:
(1)N2O(g)+CO(g)?N2(g)+CO2(g)△H=。
(2)反應Ⅰ中,斷裂2molN2(g)與1molO2(g)中的化學鍵所需能量之和(填“大于”“小于”或“等于”)斷裂2molN2O(g)中的化學鍵所需能量;反應Ⅱ需在(填“較高”或“較低”)溫度下自發進行;反應Ⅲ在熱力學上趨勢較大的原因為。
(3)T℃時,向恒容密閉容器中以物質的量之比1:1充入N2O(g)、CO(g),發生反應N2O(g)+CO(g)?N2(g)+CO2(g)。實驗測得反應前容器中的壓強為p0kPa,10min末達到平衡,容器中N2(g)的分壓為p1kPa,CO(g)的平衡轉化率為α1。
①0~10min內,平均反應速率v(N2O)=kPa?min-1(用含p1的代數式表示)。
②該溫度下,反應的平衡常數Kp=(用含p0、p1的代數式表示,Kp是用分壓表示的平衡常數,分壓=總壓×物質的量分數)。
③若在起始溫度和容積均相等的絕熱容器中重復實驗,CO(g)的平衡轉化率為α2,則α2α1(填“>”“<”或“=”),理由為。
④研究表明上述反應的一種歷程如圖所示,其中吸附在催化劑表面的物種用“*”標注。反應歷程中的決速步驟對應的過渡態為;該步驟對應反應的化學方程式為。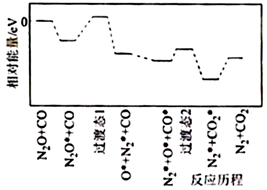 組卷:7引用:1難度:0.6
組卷:7引用:1難度:0.6
[化學--選修3:物質結構與性質]
-
11.閃鋅礦(主要成分ZnS)可用于冶煉金屬鋅和提取Ga、Ge等。回答下列問題:
回答下列問題:
(1)基態Ge原子的價電子排布圖為;第四周期主族元素中,第一電離能小于Ga的有
種。
(2)三種氟化物的熔點如表所示,其中AlF3的熔點最大的原因為。
(3)閃鋅礦焙燒煉鋅生成SO2。SO2的立體構型為物質 BF3 AlF3 GaF3 熔點/℃ -126 1040 1000 ,其中S原子的雜化方式為;與SO2互為等電子體的一種陰離子的符號為。
(4)Zn2+、Ca2+均能與NH3形成穩定離子的原因為。
(5)ZnS的立方晶胞結構如圖所示。每個晶胞中含有個由Zn2+(圖中小球表示Zn2+)形成的正四面體;若阿伏加德羅常數的值為NA,晶胞參數為apm,則晶體密度ρ=g?cm-3(用含a、NA的代數式表示)。 組卷:0引用:1難度:0.4
組卷:0引用:1難度:0.4


