2019年北京四中高考化學保溫試卷
發布:2024/4/20 14:35:0
一、本部分共20題,每小題6分,共120分。在每小題列出的四個選項中,選出最符合題目要求的一項。
-
1.“厲害了,我的國!”。下列中國制造的產品主體用料不是金屬材料的是( )

世界最大射電望遠鏡
中國第一艘國產航母
中國大飛機C919
世界最長的跨海大橋港珠澳大橋A.主體用料:鋼索 B.主體用料:鋼材 C.主體用料:鋁合金 D.主體用料:硅酸鹽 A.A B.B C.C D.D 組卷:108引用:5難度:0.9 -
2.下列指定反應的離子方程式正確的是( )
A.飽和Na2CO3溶液與CaSO4固體反應: +CaSO4?CaCO3+CO2-3SO2-4B.酸化NaIO3和NaI的混合溶液:I-+ +6H+═I2+3H2OIO-3C.KClO堿性溶液與Fe(OH)3反應:3ClO-+2Fe(OH)3═2 +3Cl-+4H++H2OFeO2-4D.電解飽和食鹽水:2Cl-+2H+ Cl2↑+H2↑通電組卷:2027引用:22難度:0.7 -
3.化合物 X是一種醫藥中間體,其結構簡式如圖所示,下列有關化合物 X的說法正確的是( )
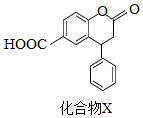
A.分子中兩個苯環一定處于同一平面 B.不能與飽和Na2CO3溶液反應 C.在酸性條件下水解,水解產物只有一種 D.1mol化合物X最多能與2molNaOH反應 組卷:140引用:19難度:0.5
二、解答題(共4小題,滿分58分)
-
 10.CO2的綜合利用對于減少溫室氣體、緩解能源緊缺具有重要的意義。
10.CO2的綜合利用對于減少溫室氣體、緩解能源緊缺具有重要的意義。
【Ⅰ】CO2的性質穩定,其電子式為。
【Ⅱ】多晶Cu是唯一被實驗證實能高效催化CO2還原為烴類(如CH4 或C2H4)的金屬。電解裝置分別以多晶Cu和鉑為電極材料,用陰離子交換膜分隔開陰、陽極室,陰、陽極室的KHCO3溶液的濃度(約0.1 mol/L左右)基本保持不變。并向某極室內持續通入CO2,溫度控制在10℃左右。
(1)持續通入CO2的原因是。
(2)研究表明,催化劑的多種因素決定了C2H4的選擇性和催化活性。
已知:選擇性=目標產物的消耗原料量原料總的轉化量
在本實驗條件下,生成C2H4的電極反應為。
(3)本實驗條件下,若CO2轉化為烴的轉化率為10%,生成C2H4的選擇性為12%,現收集到12 mol C2H4,則通入的CO2為mol。
【Ⅲ】CO2與CH4經催化重整,制得合成氣:
CH4(g)+CO2(g)2CO(g)+2H2(g)△H催化劑
(1)已知:反應1:CH4(g)═C(s)+2H2(g)△H1=+75kJ?mol-1
反應2:H2(g)+CO2(g)?H2O(g)+CO(g)△H2=+35kJ?mol-1
反應3:2CO(g)═C(s)+CO2(g)△H3=-172kJ?mol-1
則該催化重整反應的△H=kJ?mol-1.從溫度和壓強角度有利于提高CO2平衡轉化率的條件是。
(2)如圖表示體系內、c(H2)c(CO)的變化情況,請解釋1200K以下c(H2O)c(CO)小于1的原因,并解釋隨溫度的升高c(H2)c(CO)增大的原因c(H2)c(CO)。組卷:29引用:2難度:0.5 -
 11.硫代硫酸鈉(Na2S2O3)是重要的化工原料,易溶于水,在中性或堿性環境中穩定,在酸性溶液中分解產生S、SO2。
11.硫代硫酸鈉(Na2S2O3)是重要的化工原料,易溶于水,在中性或堿性環境中穩定,在酸性溶液中分解產生S、SO2。
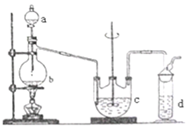
Ⅰ.Na2S2O3的制備。工業上可用反應:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,實驗室模擬該工業過程的裝置如圖所示。
(1)b中反應的離子方程式為,c中試劑為。
(2)反應開始后,c中先有渾濁產生,后又變澄清。此渾濁物是。
(3)實驗中要控制SO2生成速率,可以采取的措施有(寫出兩條)。
(4)為了保證硫代硫酸鈉的產量,實驗中通入的SO2,不能過量,原因是。
(5)制備得到的Na2S2O3中可能含有Na2SO3、Na2SO4等雜質。設計實驗,檢測產品中是否存在Na2SO4:。
Ⅱ.探究Na2S2O3與金屬陽離子的氧化還原反應。
資料:ⅰ.Fe3++3S2O32-?Fe2(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3為白色沉淀,Ag2S2O3可溶于過量的S2O32-
(6)根據實驗①的現象,初步判斷最終Fe3+被S2O32-還原為Fe2+,通過裝置 編號 試劑X 實驗現象 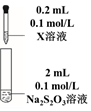
① Fe(NO3)3溶液 混合后溶液先變成紫黑色,30s后溶液幾乎變為無色 ② AgNO3溶液 先生成白色絮狀沉淀,振蕩后,沉淀溶解,得到無色溶液 (填操作、試劑和現象),進一步證實生成了Fe2+.從化學反應速率和平衡的角度解釋實驗Ⅰ的現象:。
(7)同濃度氧化性:Ag+>Fe3+.實驗②中Ag+未發生氧化還原反應的原因是。
(8)進一步探究Ag+和S2O32-反應。
Ag2S2O3+□裝置 編號 試劑X 實驗現象 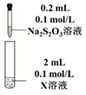
③ AgNO3溶液 先生成白色絮狀沉淀,沉淀很快變為黃色、棕色,最后為黑色沉淀。 ═Ag2S+□實驗③中白色絮狀沉淀最后變為黑色沉淀(Ag2S)的化學方程式如下,填入合適的物質和系數:
(9)根據以上實驗,Na2S2O3與金屬陽離子發生氧化還原反應和、有關(寫出兩條)。組卷:101引用:2難度:0.3


